
Cette micrographie électronique à transmission montre un nanopore à l'état solide :le cercle blanc au milieu de l'image. La structure autrement inégale résulte de la nature polycristalline d'un film d'or qui a été évaporé sur la membrane de nitrure de silicium (qui ne peut pas être vue). Crédit :Groupe Rant, TU MuenchenCopyright TU Muenchen
Un nouveau type de capteur, à base de pores à l'échelle nanométrique dans une membrane semi-conductrice, est un pas de plus vers une utilisation pratique dans des applications telles que l'analyse du contenu en protéines d'une seule cellule. Des chercheurs pionniers de la technologie des capteurs à nanopores à molécule unique à la Technische Universität München (TUM) ont montré son potentiel à travers une succession d'expériences au cours des dernières années. Maintenant, en collaboration avec des biochimistes de l'Université Goethe de Francfort, ils ont pu faire avancer cet effort au-delà de ce qui avait été un point d'achoppement :améliorer la sélectivité du capteur tout en maintenant sa sensibilité aux molécules individuelles. Ils rapportent les derniers résultats en Nature Nanotechnologie .
La recherche visant à fabriquer et à contrôler des dispositifs de diagnostic à l'échelle de molécules biologiques a progressé au point où plusieurs approches différentes sont considérées comme compétitives pour une application pratique dans un avenir relativement proche. La quête n'est pas de créer un universel, capteur à large spectre, mais plutôt une technologie de détection et d'identification de molécules uniques de protéines spécifiquement ciblées – sans qu'il soit nécessaire de les modifier en ajoutant des « marqueurs » biochimiques. Une telle technologie pourrait être utilisée, par exemple, accélérer la traduction des connaissances de la génomique en connaissances pratiques de la protéomique. Ceci est d'un intérêt vital pour la recherche médicale et pharmaceutique ainsi que pour des études biologiques plus fondamentales. Une autre application potentielle souvent mentionnée est la détection d'agents de guerre biologique.
L'une des approches les plus prometteuses est basée sur l'ingénierie d'un « point de contrôle, " un passage surveillé entre deux solutions salines séparées par une membrane artificielle. Ce soi-disant nanopore est dimensionné et façonné de sorte que les molécules doivent passer à travers une à la fois. La présence d'une molécule dans la voie produit des changements mesurables de la conductivité électrique à travers le nanopore, et d'autres améliorations peuvent affiner un tel détecteur pour en faire un « contrôle d'identité » hautement spécifique pour les molécules ciblées. Ce que la collaboration Munich-Francfort a permis, c'est une méthode robuste et réversible pour effectuer ce réglage précis :équiper un capteur à nanopores inorganiques d'une fonctionnalité biologique en ancrant des récepteurs moléculaires à l'intérieur de celui-ci. Les équipes étaient dirigées par le Dr Ulrich Rant, du Walter Schottky Institute du TUM et du TUM Institute for Advanced Study, et le professeur Dr. Robert Tampé de l'Institut de biochimie de l'Université Goethe de Francfort et du Cluster of Excellence Frankfurt (CEF) Complexes macromoléculaires.
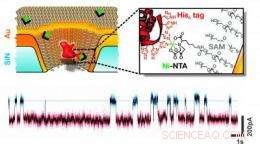
Cette illustration schématique montre un nanopore à l'état solide recouvert d'or qui est chimiquement modifié avec un seul récepteur capable de lier des molécules de protéines avec un ensemble spécifique de résidus d'acides aminés. Un exemple de trace courant en fonction du temps montre la liaison transitoire de protéines uniques. Crédit :Groupe Rant, TU Munich, Copyright TU Muenchen.
"Ce que je trouve incroyable dans les nanopores, " Rant dit, "est leur rentabilité :vous pouvez déjà mener des expériences sur une molécule unique avec un équipement d'une valeur de quelques milliers d'euros seulement. Si la technologie est commercialisée davantage, Je suis sûr que les instruments pourraient être vendus pour le prix d'un ordinateur personnel, permettant potentiellement aux gens de détecter des molécules uniques à la maison. »
La fabrication de ces dispositifs expérimentaux a commencé avec un substrat de nitrure de silicium d'à peine 50 nanomètres d'épaisseur; ainsi la membrane était littéralement une puce semi-conductrice (mais pas, bien sûr, un circuit intégré). Outils standards de l'industrie de la microélectronique, lithographie par faisceau d'électrons et gravure ionique réactive, ont été utilisés pour percer la membrane de nitrure de silicium avec des nanopores de 20 à 50 nm de diamètre. Le dépôt de vapeur a été utilisé pour recouvrir les pores de titane et d'or, et le métal a à son tour reçu un revêtement chimique auto-assemblé d'une couche moléculaire d'épaisseur. Les nanopores résultants avaient une forme conique effilée avec un diamètre à l'extrémité étroite d'environ 25 nm; ancrés dans la couche superficielle se trouvaient un petit nombre de récepteurs biochimiques conçus pour capturer et immobiliser la protéine qui donnerait au capteur sa fonctionnalité biologique. Pour ces expériences, les puces ont été montées dans une chambre de mesure avec une solution d'électrolyte de chaque côté; les molécules de protéines ajoutées à un côté de la chambre ont été poussées à travers le nanopore par une charge électrique. Des traces de changements dans le courant électrique ont donné des mesures en temps réel de molécules individuelles lorsqu'elles traversaient les nanopores - ou s'attardaient pendant qu'elles interagissaient avec la protéine immobilisée - et ces données à leur tour ont permis une identification positive des molécules cibles.

Le rendu de cet artiste illustre comment des protéines uniques sont sondées avec un nanopore artificiel dans une membrane à l'état solide métallisée. La protéine primaire (rouge foncé) ancrée dans le pore se lie de manière transitoire à un anticorps IgG (rouge clair) traversant le pore. Le temps d'interaction peut être mesuré électriquement (un exemple de trace courant/temps est montré en haut de l'image) ; cela révèle la fonction biologique de l'anticorps. Un tapis de molécules auto-assemblées (cheveux blancs) est utilisé pour enduire les parois des pores d'or, rendant la surface biologiquement inerte. Crédit :Christof Hohmann, Excellence Cluster Nanosystems Initiative Munich (NIM), droit d'auteur NIM
Les chercheurs ont pu détecter des protéines recombinantes marquées à l'histidine, et aussi pour discriminer entre les sous-classes d'anticorps IgG naturels (provenant de rats et de hamsters). Autrefois, ce niveau de sélectivité ne pouvait être atteint qu'au détriment de la sensibilité à une seule molécule. Les résultats rapportés dans Nature Nanotechnologie montrer que cet obstacle peut être surmonté, et plus encore – que l'approche est extrêmement polyvalente. Comme Rant l'explique, "La méthode que nous avons utilisée pour ancrer des protéines individuelles à l'intérieur du pore est assez générique et fonctionne pour de nombreuses protéines recombinantes disponibles. Il est donc facile de doter le nanopore à l'état solide de la fonctionnalité biologique souhaitée. Sélectionnez simplement une protéine appropriée, qui reconnaît spécifiquement les protéines cibles d'intérêt, et l'utiliser pour sonder les protéines lors de leur passage."
"L'avenir reste passionnant, " Tampé dit, « parce que la nature a une longueur d'avance sur nous en termes de sélectivité et de spécificité. Par conséquent, des améliorations supplémentaires sont nécessaires dans le domaine des systèmes sensoriels artificiels au niveau moléculaire. La collaboration entre les équipes de Munich et de Francfort représente une étape importante dans la technologie biosensorielle et nanodiagnostique sur le niveau de molécules individuelles. Rant ajoute, « La plupart des recherches récentes sur les nanopores ont été orientées vers la détection et le séquençage de l'ADN. J'espère que nos résultats montrent que les nanopores ont le potentiel de devenir également des outils importants pour la recherche sur les protéines. Et qui sait ? capteurs comme instruments de diagnostic pour détecter des marqueurs de maladie à faible abondance dans les échantillons de patients. »