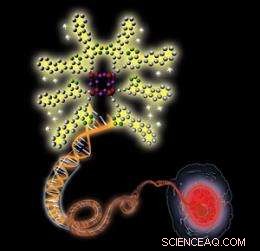
Illustration schématique montrant une nanosonde chargée positivement (en haut à gauche) se liant à une molécule d'ADN double brin chargée négativement (au centre), résultant en une fluorescence améliorée qui permet la visualisation d'un noyau cellulaire (en bas à droite). Crédit : 2010 Wiley-VCH
Les noyaux sont complexes, des organites bien définis porteurs d'informations génétiques essentielles à la cellule. La visualisation de ces organites par des techniques d'imagerie par fluorescence promet de révéler les mécanismes qui régissent l'information génétique et de fournir des moyens de prédire et de traiter les maladies génétiques. Travaillant en étroite collaboration avec Xinhai Zhang à l'Institut A*STAR de recherche et d'ingénierie des matériaux, une équipe de recherche dirigée par Bin Liu à l'Université nationale de Singapour a maintenant développé une méthode pour créer des ultrapetits, nanosondes fluorescentes hautement sélectives pour une technique d'imagerie du noyau cellulaire connue sous le nom de microscopie à fluorescence excitée à deux photons (TPEF).
Les chercheurs ont proposé un certain nombre de substances fluorescentes pour illuminer les noyaux des cellules. Cependant, phénomènes induits par la lumière, tels que l'autofluorescence cellulaire et les photodommages graves, ont tendance à dégrader les performances de ces sondes.
Dans la technique TPEF, chaque nanosonde produit un signal fluorescent en absorbant non pas un mais deux photons de faible énergie de lumière proche infrarouge. Ce processus à deux photons réduit considérablement les effets du photodommage et de l'autofluorescence cellulaire tout en améliorant la résolution, rendant le TPEF avantageux par rapport à la microscopie à fluorescence monophotonique traditionnelle.
« L'imagerie TPEF est plus puissante que l'imagerie à un photon, en particulier pour l'imagerie in vivo et tissulaire où existe une forte autofluorescence biologique, ", dit Zhang.
Au lieu d'une synthèse pas à pas traditionnelle, les chercheurs ont adopté une approche « bottom-up » pour synthétiser les nanosondes pour leur schéma TPEF. Ces nanosondes sont constituées de minuscules cages inorganiques en silicium-oxygène entourées de courtes chaînes polymères chargées positivement. L'équipe a obtenu des cages et des chaînes séparément avant de les réunir, et la synthèse se prête bien à la production de nanosondes TPEF avec diverses couleurs d'émission lumineuse et capacités de bio-reconnaissance.
Le petit, des cages rigides facilitent l'incorporation des sondes dans les noyaux cellulaires, tandis que les chaînes chargées positivement et sensibles à la lumière contribuent à la solubilité dans l'eau et aux propriétés optiques. Selon Liu, ces caractéristiques se combinent pour finalement produire des sondes lumineuses adaptées au TPEF.
L'équipe a découvert que la fluorescence des sondes devenait sensiblement plus intense lors de l'exposition aux acides nucléiques, tels que l'ADN et l'ARN double brin. En effet, les sondes chargées positivement se lient étroitement aux acides nucléiques chargés négativement par le biais d'interactions électrostatiques attractives, augmenter l'hydrophobie micro-environnementale des sondes et leur fluorescence. Par ailleurs, les sondes ont coloré sélectivement les noyaux du cancer du sein et les cellules saines avec une faible toxicité.
Les chercheurs étendent actuellement leur collection de sondes pour inclure d'autres applications cibles intracellulaires. Ils optimisent également davantage les performances TPEF des sondes. « Ces nanosondes peuvent ouvrir de nouvelles voies pour interroger les systèmes biologiques de manière contrastée et sûre, ", dit Zhang.