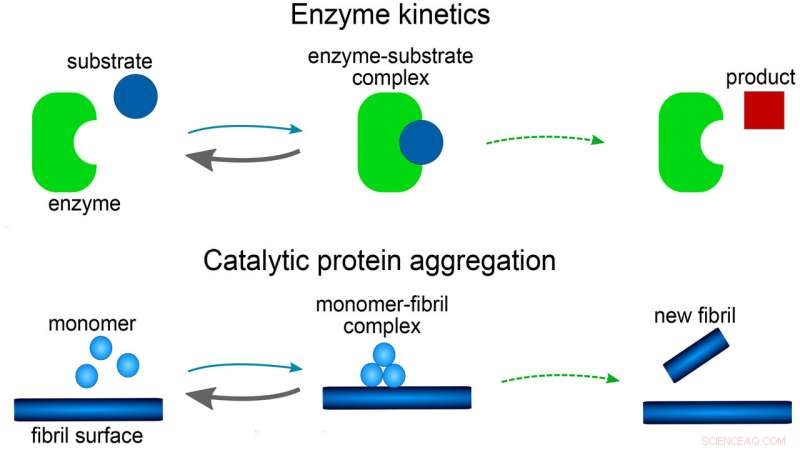
Comparaison de l'agrégation des protéines à la cinétique enzymatique. Crédit :Alexander J. Cher
Les amyloïdes sont des agrégats constitués d'empilements de milliers de protéines étroitement liées les unes aux autres. Leur formation est impliquée dans plusieurs troubles répandus, y compris la maladie d'Alzheimer et le diabète de type II.
Dans cette semaine Journal de physique chimique les scientifiques présentent un modèle mathématique pour la formation de fibrilles amyloïdes. Le modèle met en lumière la façon dont le processus d'agrégation peut se produire de manière catalytique, quelque chose qui n'a pas été bien compris auparavant.
Les chercheurs ont appliqué leur modèle à l'agrégation d'une protéine spécifique associée à la maladie d'Alzheimer, Ab40. Les résultats montrent que l'initiation du processus d'agrégation pour les fibrilles Ab40 se produit généralement aux interfaces, comme près de la surface d'une solution liquide ou de la paroi en verre d'un tube à essai. Cela a des implications importantes pour l'interprétation des données de laboratoire utilisées dans l'étude de la maladie d'Alzheimer et d'autres maladies.
Le modèle est constitué d'un ensemble d'équations mathématiques, connu sous le nom d'équations de taux, qui décrivent comment les concentrations d'agrégats de protéines changent au fil du temps. Chaque étape de réaction du modèle est analogue à celles des réactions impliquant des enzymes. Le rôle de l'enzyme est joué soit par la pointe ou le côté d'une fibre en croissance ou, peut-être, une surface du réacteur.
Les enquêteurs ont découvert que la forme mathématique de leur modèle était liée aux célèbres équations de Michaelis-Menten, publié pour la première fois en 1913 pour décrire les taux de réactions enzymatiques. Il a une forme mathématique beaucoup plus simple que tous les modèles précédents utilisés pour la formation d'amyloïde et a l'avantage supplémentaire que les équations peuvent être résolues à la main, sans avoir besoin de simulations informatiques.
"Nous nous attendons à ce que la méthodologie développée dans cet article soutienne les efforts futurs pour modéliser de nouveaux phénomènes de formation d'amyloïde, ", a déclaré le co-auteur Alexander Dear.
L'une des caractéristiques clés de la solution mathématique trouvée pour les équations de type Michaelis-Menten est un phénomène connu sous le nom de saturation. Lorsque la saturation se produit, les sites catalytiques deviennent entièrement occupés à des concentrations élevées de protéines. Dans le cas des études Ab40, la saturation montre également que le processus initiant l'agrégation fait intervenir une surface, comme la paroi d'un tube à essai.
Bien que les conclusions ne s'appliquent pas directement au corps lui-même, le co-auteur Tuomas Knowles a déclaré :"Ce travail sera central pour faciliter l'étude de la formation d'amyloïde en présence d'autres espèces trouvées dans les fluides corporels."
La co-auteure Sara Linse a déclaré :"Ce travail porte l'analyse des données expérimentales à un nouveau niveau qui sera essentiel pour dériver de puissants inhibiteurs de la formation d'amyloïde."