
La microhélice auto-résonnante. (A) Une microhélice fabriquée à cinq tours enroulée autour d'un capillaire de 0,4 mm de diamètre extérieur. Lors de la fabrication, la microhélice est étroitement enroulée autour d'un foret de 0,4 mm et collée à l'intérieur d'un cylindre Rexolite. Le foret est retiré, et la colle est laissée à sécher pendant plusieurs jours. L'ensemble microhélice est placé dans (B) un ensemble d'accouplement et de support, qui comprend un microcoupleur plan. (C) Le microcoupleur planaire se compose d'une correspondance d'impédance de ligne à ruban avec une boucle de couplage inductif. SMA, Version Sub-Miniature A. (D) Simulations de modélisation par éléments finis du champ magnétique hyperfréquence, normalisé à la puissance d'entrée, à 9,5 GHz montrent une région active de bonne homogénéité du champ magnétique sur une hauteur de 0,8 mm. Le champ magnétique micro-onde mesuré de 3,2 G/W1/2 correspond à une impulsion de 20 ns /2 à environ 20 mW. Dimensions de la microhélice, où la résonance propre est déterminée par la capacité formée entre chaque spire et l'inductance des enroulements, sont indiqués. La fréquence peut être réglée pendant la fabrication par le nombre de tours, le pas des virages, ou le diamètre intérieur. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aay1394
Les biochimistes peuvent utiliser la résonance paramagnétique électronique (RPE) sur des monocristaux de protéines pour déterminer la structure électronique ultime des intermédiaires protéiques paramagnétiques et étudier le tenseur magnétique relatif à une structure moléculaire. La méthode est, cependant, retenu par les dimensions typiques des cristaux de protéines (0,05 à 0,3 mm) qui ne fournissent pas une intensité de signal suffisante pendant la cristallographie des protéines. Dans une nouvelle étude sur Avancées scientifiques , Jason W. Sidabras et une équipe de recherche interdisciplinaire dans les départements de conversion d'énergie chimique, Photobiotechnologie, L'Institut de biologie et de physique expérimentale en Allemagne a présenté une microhélice auto-résonnante à micro-ondes pour quantifier des échantillons de nanolitres. Les scientifiques ont mis en œuvre la technique dans un spectromètre EPR commercial en bande X (fréquence moyenne; 9,5 GHz). La microhélice auto-résonnante a fourni une amélioration du rapport signal/bruit mesurée par rapport aux autres résonateurs EPR du commerce. Le travail permet aux techniques EPR avancées d'étudier les monocristaux de protéines pour la cristallographie aux rayons X, sans exclusions ou défis liés à la taille. Pour démontrer la méthode, Sidabras et al. utilisé la protéine monocristalline [FeFe]-hydrogénase (de Clostridium pasteurianum ) avec des dimensions de 0,3 mm sur 0,1 mm sur 0,1 mm.
Auteur principal Jason W. Sidabras, actuellement boursier Marie Sklowdowska-Curie Actions à l'Institut Max Planck pour la conversion d'énergie chimique en Allemagne, a en outre commenté les travaux menés avec d'autres chercheurs, le professeur Wolfgang Lubitz et le Dr Edward J. Reijerse. "Bien que nous ayons commencé avec [FeFe]-hydrogénase ici, nous avons essayé d'étudier la dynamique EPR des monocristaux pendant des années et la technologie actuelle ne se limite pas aux seuls métaux de transition. La méthode définie dans l'étude est applicable pour surveiller toute activité enzymatique au sein d'une protéine intermédiaire stable. stratégies rentables en science).
Les scientifiques utilisent généralement la spectroscopie EPR pour étudier le cycle catalytique des enzymes redox qui contiennent des intermédiaires paramagnétiques et obtenir des informations sur la structure électronique et géométrique d'un site enzymatique actif. Généralement, afin de mener des expériences EPR sur des protéines, les chercheurs préparent une solution congelée (concentration comprise entre 0,1 et 1 mM) et placent un volume (200 µl) dans une cavité micro-onde pour obtenir des interactions magnétiques sur un site actif, avec une vue limitée de la structure électronique. Pour résoudre complètement les paramètres d'interaction magnétique du tenseur, ils doivent réaliser des expériences EPR monocristallines où les tenseurs d'interaction magnétique peuvent être combinés avec la cristallographie aux rayons X pour démontrer la géométrie des protéines et comprendre les mécanismes catalytiques des enzymes. Cependant, La RPE monocristalline est rarement appliquée aux systèmes protéiques en raison des difficultés d'obtention de cristaux avec des volumes et des tailles appropriés. De nombreuses protéines dans la plage de 0,05 à 0,3 mm sont trop petites pour être analysées à l'aide d'instruments EPR commerciaux.
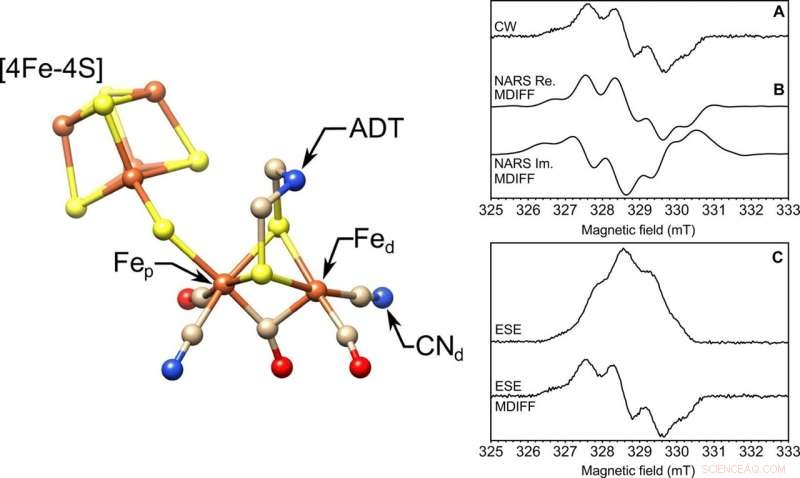
À GAUCHE :La structure moléculaire du site actif [FeFe]-hydrogénase, le cluster H. Les fers proximaux et distaux sont mis en évidence, Fep et Fed, respectivement, le ligand cyanure (CN-d), et le ligand ADT. S, jaune; Fe, Orange; N, bleu; C, bronzer; , rouge. La structure provient de la Protein Data Bank (PDB) ID 4XDC. DROITE :EPR en solution congelée sur un échantillon de 85 nl en bande X. Trois expériences EPR réalisées avec une microhélice auto-résonnante de 0,4 mm de diamètre interne. Montré sont les (A) onde continue (CW), (B) scan rapide non adiabatique réel (Re.) et imaginaire (Im.) (NARS), et (C) des expériences ESE EPR à deux impulsions balayées sur le terrain du radical tyrosine D (Y∙D) dans le photosystème II avec 85 nl d'échantillon de solution congelée à une température de 80 K. Calcul de la pseudo-modulation MDIFF (différence mobile) de 0,5 mT est indiqué pour les expériences NARS et ESE à balayage sur le terrain à comparer directement à l'expérience EPR à ondes continues. Le temps total pour les expériences était de 49, 55, et 45 min, respectivement. Le rapport signal sur bruit est calculé et tabulé. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aay1394.
Pour améliorer la sensibilité EPR pour étudier les monocristaux, généralement à la bande X, les chercheurs doivent abandonner la conception de la cavité micro-ondes et s'orienter vers des résonateurs à petit volume dans la gamme des micro-ondes. La stratégie peut faciliter la réduction des volumes d'échantillons de 200 à 20 µl à l'aide d'un résonateur loop-gap (LGR) et des réductions supplémentaires avec des matériaux à constante diélectrique élevée pour réduire le volume actif à un microlitre. Les recherches sur les monocristaux de protéines nécessitent des réductions de volume encore plus importantes (moins de 0,03 µl) et cela nécessite une approche radicale. Pour y parvenir, Sidabras et al. combiné une microhélice auto-résonnante et un microcoupleur plan sur une configuration de carte de circuit imprimé, qui a entraîné la microhélice auto-résonnante placée au centre de la boucle de couplage. La géométrie de la microhélice offrait des avantages avec une homogénéité du champ micro-ondes fortement améliorée et une sensibilité au volume plus élevée pour les petits échantillons par rapport aux autres microrésonateurs. L'équipe a optimisé la microhélice auto-résonnante pour des expériences d'impulsions et d'ondes continues nécessitant très peu de puissance micro-ondes. Ils ont facilement adapté et réglé la microhélice sur une variété d'échantillons et de températures.
Dans le travail present, l'équipe a utilisé la microhélice auto-résonnante pour étudier la rotation des cristaux EPR de [FeFe]-hydrogénase à l'état oxydé actif (H
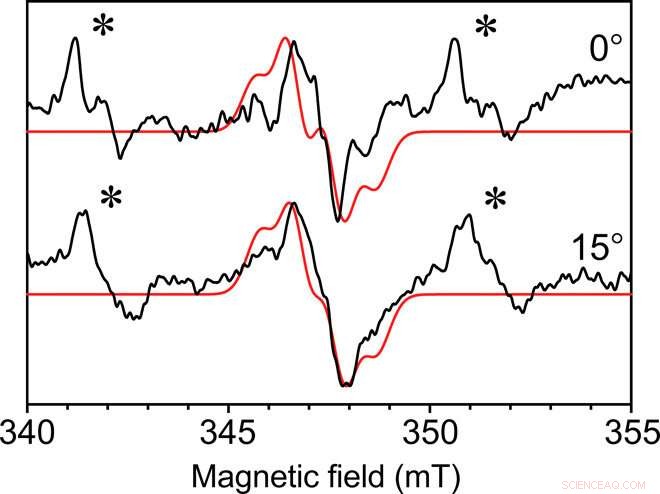
EPR monocristallin à onde continue de Y∙D dans le complexe central du photosystème II. EPR à onde continue collectée avec la microhélice auto-résonnante de diamètre interne de 0,4 mm à deux angles du radical du photosystème II Y∙D à partir d'un monocristal à une température de 80 K. Les dimensions du cristal étaient de 0,3 mm sur 0,18 mm sur 0,18 mm. En rouge, une simulation ajustée avec des caractéristiques similaires. Un signal Mn2+ lié non spécifiquement est également présent dans la liqueur mère du cristal, indiqué par un astérisque (∗). Chaque spectre a été collecté en 49 min avec un rapport signal/bruit d'environ 35. Crédit :Science Advances, doi:10.1126/sciadv.aay1394.
Ils ont utilisé un radical tyrosine D à longue durée de vie (Y∙D) comme sonde standard lors d'expériences avec des propriétés précédemment bien caractérisées. Pour générer le signal EPR du radical tyrosine (Y∙D), l'équipe a illuminé des échantillons du complexe central du photosystème II (complexe protéique membranaire) à la lumière ambiante et les a rapidement congelés. Ils ont mené plusieurs expériences pour démontrer la polyvalence de la microhélice lors des mesures EPR sur une variété d'échantillons (moins de 85 nanolitres en volume) en bande X. Sidabras et al. utilisé les cristaux du photosystème II comme référence malgré sa constitution difficile. Structurellement, le complexe du photosystème II contenait une masse moléculaire d'environ 350 kDa, chaque composant ne contenant qu'un seul radical Y∙D. Au total, avec huit complexes du photosystème II par cellule unitaire, les scientifiques ont calculé 8,9 x 10 12 radicaux Y∙D, démontrer la polyvalence de la méthode EPR pour étudier de grands complexes dans de petites dimensions cristallines.
Après avoir établi l'adéquation de la microhélice auto-résonnante pour étudier des échantillons de protéines monocristallines, l'équipe a étendu les travaux pour démontrer la détermination complète du tenseur g angulaire (déplacement d'énergie associé à la transition moléculaire) et pour examiner des expériences d'EPR à impulsions avancées telles que la modulation d'enveloppe d'écho de spin électronique (ESEEM) ou la corrélation de sous-niveau hyperfin (HYSCORE). Ils ont optimisé la microhélice auto-résonnante pour ces expériences. L'équipe a balayé sur le terrain des expériences EPR (écho de spin électronique) à deux impulsions sur un monocristal de protéine de la [FeFe]-hydrogénase de C. pasteurianum (Cpl) dans le H oxydé

Pulse EPR sur un monocristal de l'amas H dans [FeFe]-hydrogénase. (A) La structure moléculaire du site actif [FeFe]-hydrogénase, le cluster H, de PDB ID 4XDC est montré avec le cadre moléculaire situé avec le fer distal (Fed) comme origine. S, jaune; Fe, Orange; N, bleu; C, bronzer; , rouge. (B) Le schéma de symétrie P1211 reliant le cadre moléculaire (x, oui, z) au cadre en cristal (a, b, c) et, dernier, au cadre du système de laboratoire (L1, L2, L3) s'affiche. Les deux cadres moléculaires de l'unité asymétrique sont présents dans le site I et peuvent être traduits en site II par des opérations de symétrie cristalline. (C) Le champ magnétique statique (B0) est positionné le long de l'axe L1, tandis que le champ magnétique hyperfréquence (B1) peut être soit le long de l'axe L2 soit le long de l'axe L3. Une rotation de 180° est réalisable autour de l'axe L3, mais seule une rotation partielle autour de l'axe L2 est possible en raison de la rotation de B1 avec le cristal, ce qui fait que B1 devient parallèle à B0. Une troisième rotation partielle est réalisable si l'échantillon est tourné de 90° autour de l'axe L2. (D) Expériences Pulse EPR collectées avec la microhélice auto-résonnante de diamètre interne de 0,4 mm avec un monocristal [FeFe]-hydrogénase de C. pasteurianum (CpI) dans l'état Hox montrant les données collectées dans un plan pour une rotation complète de 180 ° par pas de 5° à une température de 15 K. Les dimensions du cristal étaient d'environ 0,3 mm sur 0,1 mm sur 0,1 mm, et chaque spectre a été collecté en 8 min avec un rapport signal/bruit d'environ 290. (E) Une vue stéréo du tenseur g analysé (gx, rouge; gy, vert; et gz, bleu) est mappé sur la structure cristalline (ID PDB :4XDC). Pour une vue en trois dimensions (3D) du tenseur g proposé, voir https://act-epr.org/FeFeHydrogenase.html. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aay1394.
Ils ont ensuite inclus un cryoprotecteur et un milieu dans la microhélice suivi d'une congélation flash pour produire un signal EPR avec quatre signaux distincts dans le spectre par rapport à la structure de la protéine. Les scientifiques ont intégré les données dans des simulations relatives à différents référentiels définis via le progiciel de simulation EasySpin pour la simulation du spectre EPR. L'équipe a créé un schéma reliant le cadre moléculaire du cluster [FeFe]-hydrogénase H au cadre du système de laboratoire. Pour toutes les espèces examinées dans les expériences, l'équipe a déterminé l'amplitude et l'orientation du tenseur g à l'aide de la théorie du champ de ligand et a vérifié les résultats à l'aide de calculs de chimie quantique. L'équipe a facilité des informations fondamentales sur la structure électronique et a noté leur dépendance vis-à-vis de la sphère du ligand et a observé la nécessité de stratégies optimisées.
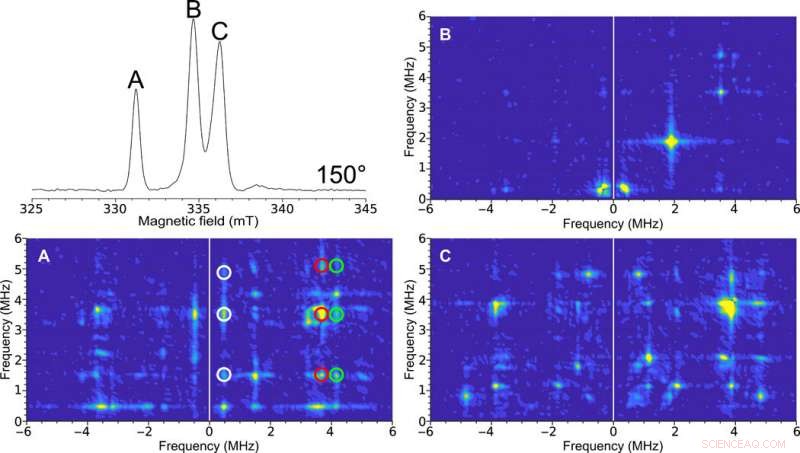
Monocristal HYSCORE EPR du cluster H dans [FeFe]-hydrogénase. En haut à gauche :spectre ESE EPR à deux impulsions à balayage de champ à 150°. Les étiquettes des figures (A, B, et C) sont représentatifs des pics spectraux. Les spectres HYSCORE collectés avec la microhélice auto-résonnante de 0,4 mm de diamètre interne d'un monocristal [FeFe]-hydrogénase de C. pasteurianum (CpI) à l'état Hox à une orientation de 150° collecté à une température de 15 K. Le 2D la représentation de la densité montre des corrélations entre les transitions de spin nucléaire dans les deux projections du spin électronique. (A) Nettoyer le spectre HYSCORE en raison du pic correspondant à un seul des signaux EPR dans la cellule unitaire du cristal. Les caractéristiques corrélées entre ces transitions sont indiquées par le blanc, rouge, et des cercles verts. (B) Le spectre HYSCORE relativement sans particularité suggère peu d'interaction hyperfine à cette orientation. (C) HYSCORE sur deux signaux EPR superposés représentant différentes orientations de la molécule d'enzyme par rapport au champ magnétique. L'HYSCORE a été configuré à l'aide de l'assistant Bruker HYSCORE avec les paramètres suivants :π/2, 40 ns ; , 280 ns; et , 48 ns with 256 points each and 20 shots per point. Each HYSCORE spectrum was collected in approximately 1 hour. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aay1394.
The researchers illustrated more advanced experiments for single-crystal studies using HYSCORE (hyperfine sublevel correlation) experiments for the ESE (electron spin echo) EPR dataset. Pour ça, they obtained a single-crystal 2-D spectrum for the H-cluster in [FeFe]-hydrogenase crystals and identified six main transitions. Sidabras et al. highlighted the feasibility of these advanced EPR techniques in the present work and related them to the electronic structure predicted using quantum chemical calculations. The team aim to address additional molecular couplings of ligands in depth using ESEEM/HYSCORE techniques in the future.
De cette façon, Jason W. Sidabras and colleagues presented an advanced resonator to design and collect EPR data from a 3 mm by 0.1 mm by 0.1 mm single crystal of [FeFe]-hydrogenase in the H
© 2019 Réseau Science X