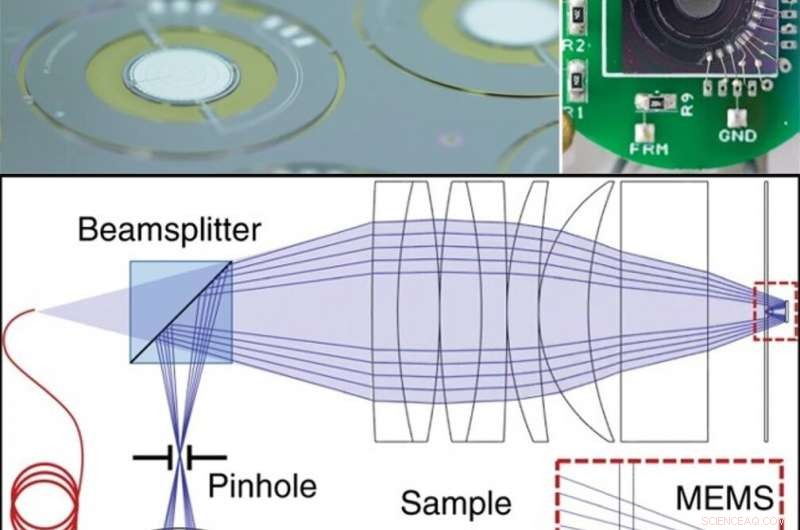
EN HAUT :Miroir de balayage 3D MEMS intégré. (a) Dispositifs sur plaquette après le processus de libération. (b) Le scanner MEMS après le câblage pour supporter le PCB. EN BAS :Diagramme schématique de la configuration d'imagerie confocale. Une vue agrandie du scanner MEMS, hyperhémisphère, et l'étape de l'échantillon. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0167-5
Les microscopes à balayage laser peuvent être miniaturisés pour imager des microenvironnements in vivo via l'inclusion à l'intérieur de dispositifs de système micromécanique optique (MEMS) pour remplacer les composants plus gros existants. Les dispositifs optiques actifs multifonctionnels sont des composants émergents qui prennent en charge la miniaturisation pour des performances limitées par la diffraction avec des conceptions de systèmes optiques plus simples dans les dispositifs optiques. Dans une étude récente, Tianbo Liu et une équipe de chercheurs des départements de génie électrique et informatique et de dermatologie aux États-Unis ont proposé un objectif de microscope catadioptrique (permettant à la fois la réflexion et la réfraction de la lumière), doté d'un dispositif MEMS intégré pour effectuer un balayage biaxial, réglage de la mise au point axiale et contrôle de l'aberration sphérique.
Les scientifiques des matériaux ont inclus un scanner MEMS réfléchissant dans l'architecture MEMS-in-the-lens pour prendre en charge l'imagerie à grande ouverture numérique (NA) qui recueille la lumière sur une plus large gamme d'angles pour générer des images. Liu et al. mis en œuvre l'architecture MEMS-in-the-lens en incluant le miroir de balayage dans l'objectif, où l'axe du faisceau était normal à la surface du miroir sans avoir besoin d'un séparateur de faisceau pour séparer le faisceau incident et réfléchi. Ils ont démontré les performances optiques du système catadioptrique (un système optique qui permet à la fois la réfraction et la réflexion de la lumière avec une aberration minimale) en imageant des cibles dures et molles à l'aide d'un microscope confocal basé sur la nouvelle conception de l'objectif. La technique d'imagerie améliorée permettra un diagnostic avancé des conditions médicales. Les résultats de l'étude sont maintenant publiés sur Lumière :science et applications .
Les organes non préparés et non nettoyés chez les animaux vivants peuvent être imagés in vivo en utilisant des techniques de microscopie confocale et multiphotonique à balayage laser. Les progrès techniques ont facilité l'imagerie de paillasse de petits modèles animaux tels que les souris, avec des applications médicales appropriées émergeant également dans les cliniques de dermatologie pour examiner de manière non invasive les biopsies cutanées optiques. Cependant, les microscopes à balayage laser conventionnels sont volumineux et limitent les procédures d'imagerie médicale et animale vivante. Pour accéder au corps humain et imager les animaux ambulants, les scientifiques doivent donc miniaturiser ces instruments.
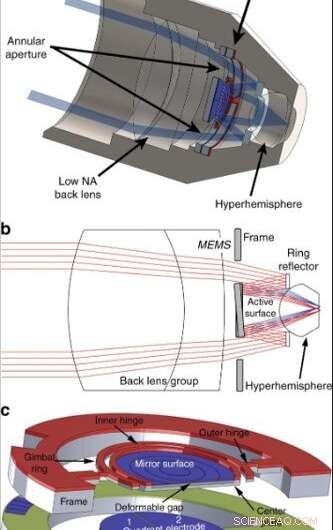
Architecture MEMS dans la lentille. (a) Une vue en coupe transversale du microscope confocal miniaturisé avec une nouvelle lentille d'objectif qui intègre un scanner 3D MEMS. (b) Une illustration du chemin lumineux à travers l'ouverture annulaire et le balayage du faisceau du dispositif MEMS. (c) Un modèle du scanner 3D MEMS. Une plate-forme à cardan est liée à un ensemble d'électrodes en quadrant. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0167-5
Des mécanismes de balayage miniaturisés avec des instruments plus petits tels que des dispositifs de système micromécanique peuvent remplacer les mécanismes volumineux existants requis pour balayer et focaliser le faisceau pour des applications jusqu'à présent improbables. Par exemple, les scientifiques ont pu monter un microscope à deux photons miniaturisé à balayage MEMS pesant seulement 2,15 g sur la tête d'une souris se déplaçant librement pour l'imagerie cérébrale. Les dispositifs ont également facilité l'adaptation de la microscopie à balayage laser dans les plates-formes endoscopiques et lors d'expériences de biopsie optique basées sur MEMS pour détecter le cancer in vivo. Outre son encombrement réduit, un scanner MEMS contribue à la miniaturisation en associant plusieurs degrés de liberté lors de sa fabrication à son architecture optique.
Dans le travail present, Liu et al. exploré une nouvelle architecture optique pour une miniature, Microscope laser à balayage à haute NA avec un scanner MEMS 3-D dans l'objectif. Ils ont illustré la disposition optique du MEMS dans la lentille pour fabriquer le dispositif et le faire fonctionner in vivo. Les scientifiques ont conçu le miroir de balayage 3D MEMS en reproduisant avec succès une méthode précédemment introduite par le même groupe. Pour la microscopie in vivo, ils ont opéré l'hyperhémisphère (qui offre un champ de vision plus large) au contact de tissus contenant un indice de réfraction variable allant de 1,3 à 1,4. En fonction des paramètres, les scientifiques ont simulé les performances d'imagerie de l'installation. Ils ont conclu que l'hyperhémisphère du verre BK-7 était efficace comme élément de lentille frontale pour un microscope tissulaire avec un scanner MEMS 3D actif déployé à l'ouverture simulée.
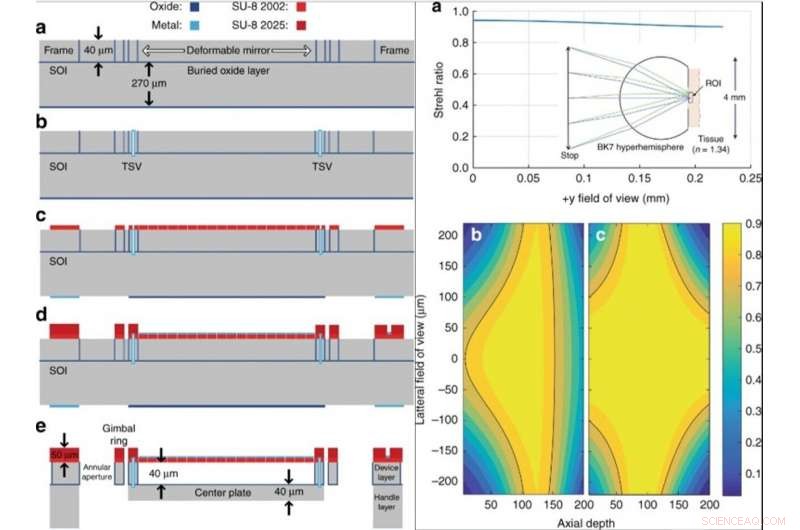
GAUCHE :Diagramme schématique de fabrication de plaquettes à cardan. (a) Eau-forte, oxydant, et modeler les arrêts de gravure verticaux. (b) Création de TSV. (c) Revêtement par centrifugation et modelage de la membrane déformable. (d) Dépôt et modelage du métal de la face supérieure et revêtement par centrifugation et modelage des charnières SU-8. (e) Plate-forme de cardan entièrement libérée. À DROITE :performances d'imagerie simulées. (a) Une simulation Zemax d'un hyperhémisphère BK-7 de 2 mm de rayon qui est en contact avec le tissu. Le diaphragme est à 2,5 mm à gauche de l'objectif, avec NA = 0,7, avec un graphique du rapport de Strehl en fonction du champ latéral, simulé pour une profondeur de 125 μm. (b), (c) Un tracé de contour du rapport de Strehl sur une coupe axiale 2D du champ de vision 3D. La ligne noire représente le contour pour S = 0,8. b Sans réglage en profondeur de l'aberration sphérique. (c) Avec réglage de l'aberration sphérique en fonction de la profondeur. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0167-5
Pour démontrer l'imagerie confocale, les scientifiques ont utilisé une maquette de paillasse de l'objectif avec un miroir MEMS 3D intégré. Liu et al. fixé le miroir sur la platine de l'échantillon à l'aide d'une fine couche de gel à ultrasons à base d'eau. Par exemple, ils ont introduit des échantillons de cellules de joue humaine (~ 80 µm) sur la platine d'échantillonnage, et capturé leurs images à l'aide du microscope par la suite. Pendant l'imagerie, les scientifiques ont utilisé un laser hélium-néon de 633 nm pour l'éclairage. Ils ont ensuite fixé l'échantillon d'intérêt sur la plaquette de verre en face de la lentille hyperhémisphère. Liu et al. inclus un diviseur de faisceau 50/50 entre la fibre optique et l'élément de lentille composé pour séparer la lumière réfléchie, et un sténopé de 10 µm pour filtrer spatialement la lumière réfléchie.
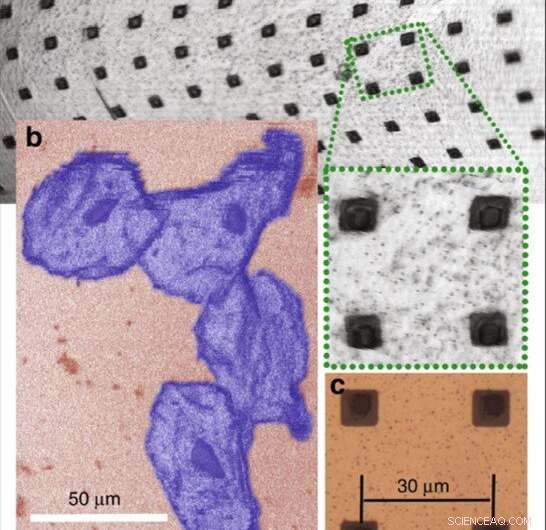
Résultats d'imagerie expérimentale. a Une image confocale de la surface d'un prototype de scanner tridimensionnel. Une sous-section de l'image est agrandie numériquement pour montrer les détails. b Une image confocale de cellules de joue humaines (avec fausse coloration). Le noyau et les membranes cellulaires sont clairement visibles. c Une image au microscope à épi-illumination à fond clair recadrée numériquement de la surface d'un miroir prototype similaire qui a été enregistrée à l'aide d'un objectif × 50 (NA = 0,8). Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0167-5
Le microscope confocal MEMS a également permis l'imagerie sous la surface de l'échantillon et Liu et al. l'a démontré via l'imagerie d'un échantillon d'intérêt. Pour l'échantillon, ils ont suspendu des microbilles de polystyrène de 6 µm dans un gel de transmission d'ultrasons, puis ont suivi le processus d'imagerie avec une reconstruction volumétrique des images pour mieux illustrer la coupe confocale à différents plans focaux. Bien que les images aient été bien résolues, les scientifiques ont observé que les profils 3-D des billes n'étaient ni uniformes ni symétriques nécessitant une optimisation supplémentaire de la technique.
Le miroir MEMS 3-D développé a fourni un contrôle complet du balayage et de la mise au point pour l'instrument, en plus du contrôle électronique de l'aberration sphérique. Les nouveaux travaux ont montré une résolution améliorée par rapport aux miroirs MEMS 3D décrits précédemment, pour permettre son inclusion dans un système compact MEMS-in-the-lens.
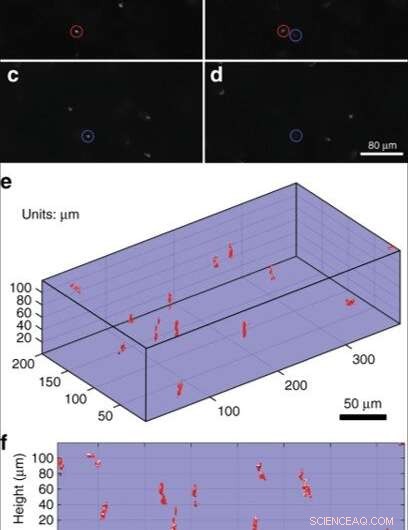
Démonstration d'imagerie 3D. (a–d) Section confocale de billes de polystyrène de 6 µm de diamètre en suspension dans du gel à ultrasons. Deux perles ont été encerclées en utilisant des couleurs différentes pour montrer leur changement de mise au point d'une image à l'autre. (e) Une reconstruction volumétrique à partir des images enregistrées à chaque plan focal. (f) Une projection au premier angle à travers le rendu volumétrique pour mieux illustrer la coupe confocale à différents plans focaux. Crédit :Lumière :Science &Applications, doi:10.1038/s41377-019-0167-5
De cette façon, Tianbo Liu et ses collaborateurs ont proposé et développé un objectif de microscope catadioptrique MEMS dans la lentille et intégré un scanner 3D MEMS pour effectuer un balayage biaxial avec une aberration sphérique contrôlée pendant les applications d'imagerie. Liu et al. simulé le développement de l'architecture de l'instrument proposé pour indiquer une promesse considérable pour l'avenir, microscopes à balayage laser miniaturisés et à haute NA pour les applications d'imagerie in vivo.
© 2019 Réseau Science X