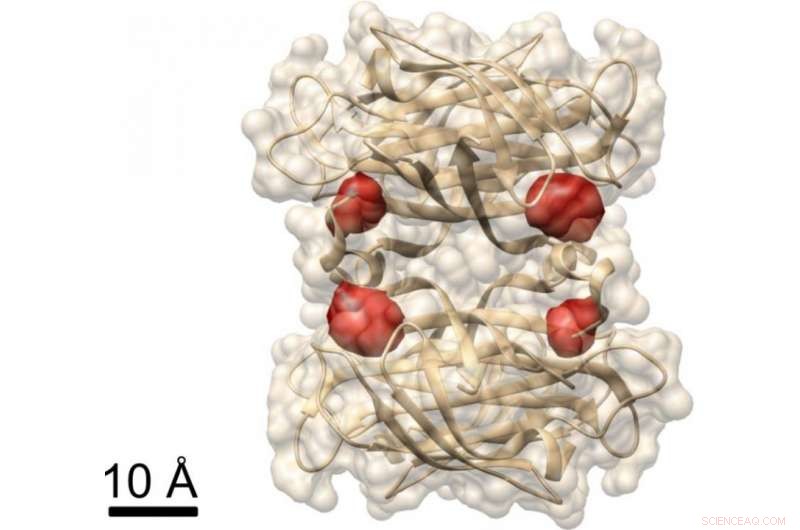
Vue d'une protéine :les chercheurs de Max Planck ont utilisé la méthode COLD pour visualiser les quatre sites de liaison de la biotine (marqués par des molécules de colorant rouge) dans la protéine streptavidine, dont la structure est déjà connue. Crédit :MPI pour la Science de la Lumière
La microscopie optique continue de révéler le monde microscopique à une résolution toujours plus grande. En utilisant une nouvelle méthode appelée COLD, des scientifiques de l'Institut Max Planck pour la science de la lumière à Erlangen ont maintenant visualisé des structures de protéines avec une résolution d'environ 5 Å. COLD atteint cette résolution sans précédent en fonctionnant à une température de moins 270 degrés Celsius. A des températures aussi basses, les signaux des protéines fluorescentes peuvent être localisés plus précisément. Le procédé ouvre ainsi la possibilité de basses températures, les signaux des protéines fluorescentes peuvent être localisés plus précisément. La méthode ouvre ainsi la possibilité d'observer des changements structurels de protéines associés à des maladies spécifiques.
Jusqu'à la fin du 20e siècle, les microscopes optiques étaient soumis à une restriction majeure :leur résolution était limitée par la nature ondulatoire de la lumière. Dès 1873, le physicien Ernst Abbe a formulé une loi qui, en termes simplifiés, déclare qu'un microscope optique ne peut pas résoudre des structures mesurant moins de la moitié de la longueur d'onde de la lumière visible - environ 200 nanomètres. "Cela correspond à une chaîne de plusieurs milliers d'atomes, " explique Vahid Sandoghdar, Directeur à l'Institut Max Planck pour la science de la lumière.
Cette limite était considérée comme insurmontable - jusqu'à ce que les chercheurs développent des méthodes de microscopie à fluorescence à super-résolution, tels que STED et PALM / STORM, au cours des deux dernières décennies. Ces techniques ont amélioré la résolution optique à environ 20 à 30 nanomètres seulement. En 2014, les scientifiques impliqués dans ces inventions, dont Stefan Hell à l'Institut Max Planck de chimie biophysique à Göttingen, ont reçu le prix Nobel de chimie. Récemment, une équipe dirigée par Hell a augmenté la limite de résolution de vingt fois supplémentaires à l'aide d'une technique de microscopie nouvellement développée connue sous le nom de MINFLUX. La résolution de cette méthode était suffisante pour distinguer des molécules voisines distantes de quelques nanomètres.
Le FROID permet d'avoir un aperçu des molécules de protéines individuelles
Vahid Sandoghdar et ses collègues travaillent depuis plusieurs années sur des méthodes alternatives pour augmenter les performances de la microscopie à fluorescence à haute résolution - avec un succès considérable, comme le rapporte le physicien d'Erlangen :« Notre nouvelle approche nous permet d'afficher des structures séparées par une distance de moins de cinq angströms, c'est-à-dire un demi-nanomètre. Nous sommes donc en mesure d'étudier des molécules protéiques. » Sandoghdar et ses collègues ont présenté le concept de base pour la première fois en 2013, qu'ils ont inventé COLD pour la localisation optique cryogénique en trois dimensions. Le nom COLD dit tout :« L'élément clé du COLD est la basse température à laquelle les mesures ont lieu, environ moins 270 degrés Celsius, " dit le physicien.
Le principe de base de l'imagerie par fluorescence est le même pour tous les microscopes :l'échantillon est d'abord marqué chimiquement avec des molécules fluorescentes appelées fluorophores. Cela rend certaines zones ou composants de l'échantillon, par exemple. cellules, visible. Cependant, les techniques conventionnelles sont limitées par la limite d'Abbe. Chaque fois que plusieurs fluorophores rapprochés émettent de la lumière simultanément, leurs signaux se chevauchent et ne peuvent plus être reconnus comme des points séparés. Les méthodes de super-résolution, par contre, sont capables d'activer et de désactiver les molécules de coloration fluorescente. Ceci permet de déterminer la position de chacun avec un degré de précision relativement élevé. Cependant, la précision souffre du bruit statistique :plus les fluorophores émettent de la lumière brièvement, plus l'imprécision est grande. Et généralement, ils ne s'allument que très peu de temps, parce que les processus chimiques induits par la lumière blanchissent la molécule.
Les molécules peuvent être localisées plus précisément à basse température
C'est là que le FROID entre en jeu. Les températures extrêmement basses ralentissent énormément le photoblanchiment, de sorte que chaque fluorophore s'allume beaucoup plus longtemps. "Cela réduit le bruit sur les images et améliore la précision de la localisation, " déclare Siegfried Weisenburger, qui a effectué les expériences dans le cadre de sa recherche doctorale dans le département de Sandoghdar.
En collaboration avec Christian Griesinger et son département à l'Institut Max Planck de chimie biophysique de Göttingen, les scientifiques d'Erlangen ont pu utiliser leur technique pour résoudre deux fluorophores sur une protéine distants d'à peine un nanomètre. A cette échelle, même les moindres vibrations et mouvements de l'échantillon ruineront l'expérience. "Pour mesurer les distances à l'échelle atomique, nous avons dû développer un spécial, microscope cryogénique extrêmement stable, " explique Sandoghdar. " Les échantillons sont préparés en répartissant les protéines dans un film polymère mince sur une lame de verre. "
Comment les protéines sont-elles disposées dans une membrane ?
Dans une autre expérience, les chercheurs ont démontré que COLD peut être utilisé pour déterminer la structure spatiale des protéines :ils ont marqué une protéine appelée streptavidine à quatre sites spécifiques avec des fluorophores et ont enregistré plusieurs centaines d'images. Ils ont ensuite reconstruit la structure de la protéine à l'aide d'algorithmes de tomographie. Finalement, ils ont atteint une résolution tridimensionnelle d'environ un demi-nanomètre en localisant les quatre molécules de colorant. "Cette résolution permet des études de structure à la limite d'autres méthodes en biologie structurale." Cela vaut notamment pour le domaine de recherche de Christian Griesinger, spectroscopie RMN, qui ne peut résoudre que des distances inférieures à cinq angströms. "COLD comble le fossé entre la microscopie à fluorescence et la biologie structurale, " dit le directeur Max Planck à Göttingen.
Les résultats sont très pertinents pour un certain nombre de scientifiques. « Dans les cellules, les protéines changent de structure pour remplir ou modifier leurs fonctions. De plus, des changements structurels spécifiques sont souvent associés à des maladies spécifiques, " dit Sandoghdar. De plus, Le FROID peut déterminer l'orientation des protéines. "L'orientation est particulièrement intéressante quand on regarde avec des protéines dans une membrane. C'est l'objet de nos expérimentations en cours, " explique Daniel Böning, membre de l'équipe de recherche à Erlangen.
Sandoghdar s'attend à ce que la résolution de FROID puisse être encore améliorée d'un facteur dix. La technique fonctionnerait alors au niveau atomique. Cependant, dans ce cas elle se heurterait à la limite intrinsèque de la microscopie à fluorescence résultant de la taille des molécules marqueurs utilisées. "COLD est idéal pour visualiser des protéines ou de plus petits agrégats de biomolécules. D'autre part, en raison des températures inhospitalières, la technique ne peut pas être utilisée pour étudier les processus au sein des cellules vivantes, » résume Sandoghdar. « Pour le moment, aucune méthode de microscopie n'est capable de tout observer. Les différentes stratégies doivent donc continuer à être utilisées - comme avant et dans un avenir prévisible - de manière complémentaire."