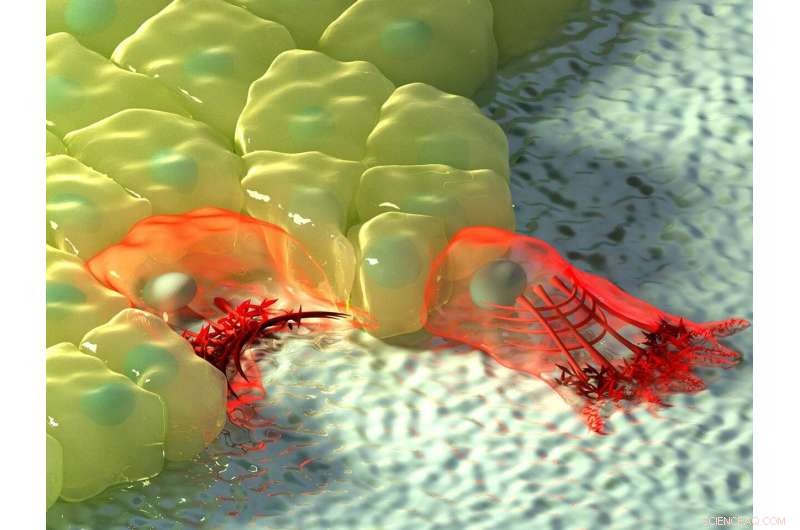
La figure ci-dessus montre une illustration artistique des cellules dans les régions de courbure négative (gauche) et positive (droite). A courbure négative, le flux d'actine se dirige vers le câble d'actine au bord de la cellule, représenté par l'augmentation de l'intensité de la couleur, et le câble contractile soulève le bord au-dessus du substrat. A courbure positive, les lamellipodes s'étendent de la cellule pour ramper le long du substrat, et ces protubérances sont caractérisées par un flux d'actine rétrograde vers l'intérieur de la cellule. Crédit :Institut de mécanobiologie, université nationale de Singapour
Face à un terrain difficile, les véhicules tout-terrain peuvent passer de deux à quatre roues motrices pour continuer à avancer. De la même manière, la migration cellulaire peut être entraînée soit par une exploration dirigée par protrusion, ou par des forces de traction contractiles, mais comment la cellule bascule entre ces deux méthodes reste un mystère. Une étude collaborative menée par le doctorant MBI Tianchi Chen et le professeur Benoit Ladoux du Mechanobiology Institute (MBI) de l'Université nationale de Singapour, a découvert que la direction dans laquelle les filaments d'actine s'écoulent à l'intérieur de la cellule lui permet de détecter la courbure physique de son environnement, et ce flux directionnel est l'interrupteur à clé qui détermine quelle méthode de migration est sélectionnée. Le travail a été publié dans le numéro d'avril 2019 de Physique de la nature .
Réorganisation induite par la courbure du flux d'actine
La migration cellulaire est un processus biologique essentiel qui entraîne la formation de tissus et d'organes au cours du développement embryonnaire, et aide également à protéger le corps grâce à la réponse immunitaire et aux mécanismes de cicatrisation des plaies. Les changements de forme nécessaires à la migration cellulaire dépendent de l'organisation dynamique et de la génération de force à partir du cytosquelette d'actomyosine interne de la cellule, qui est composé de filaments structuraux d'actine et de protéines motrices contractiles de la myosine.
La réorganisation de ces composants permet deux mécanismes de migration cellulaire :la croissance et l'extension de protubérances lamellipoïdales à base d'actine qui permettent à la cellule de « ramper » vers l'extérieur, ou la formation de gros câbles contractiles d'actomyosine qui peuvent tirer la cellule vers l'avant tout en générant des forces de traction sur le substrat. Cependant, le processus par lequel la cellule choisit de former des protubérances ou des câbles contractiles reste incertain.
Selon la topographie de l'environnement physique, les cellules peuvent rencontrer des régions de courbure positive ou négative. La courbure positive fait référence à une forme convexe qui se courbe vers l'extérieur, un peu comme une lettre majuscule 'D', considérant qu'un exemple de la courbure négative opposée peut être vu dans la lettre "C", qui forme une forme concave qui se courbe vers l'intérieur. En observant la migration des cellules épithéliales sur des motifs de substrat en forme de fleur qui sont utilisés pour les tests de fermeture de plaie, un international, équipe de recherche multidisciplinaire dirigée par le professeur Ladoux en collaboration avec les chercheurs principaux du MBI, le professeur agrégé Boon Chuan Low et le professeur agrégé Yusuke Toyama, avec des physiciens théoriciens et des pairs chercheurs en France, Chili, Israël et l'Espagne ont constaté que dans les régions de courbure positive, les cellules ont développé des lamellipodes pour l'exploration cellulaire, et dans les régions de courbure négative, câbles d'actine forts assemblés qui ont suivi le bord concave.
Une observation plus poussée de la dynamique de l'actine en temps réel à l'aide de la microscopie à cellules vivantes a révélé une différence dans la direction du flux d'actine au niveau des deux courbures. Dans les lamellipodes induits par une courbure positive, le flux d'actine était rétrograde, c'est-à-dire loin de la membrane cellulaire dans la direction opposée à la saillie. Inversement, aux courbures négatives, le flux d'actine était antérograde, c'est-à-dire vers la membrane cellulaire où se trouvait le câble d'actine.
Ce flux antérograde entraîne l'assemblage de structures d'actine polarisées dans ces régions de courbure négative. Le câble d'actine au bord concave est situé à l'avant, suivi de fibres d'actine transversales orientées dans le même sens que le câble d'actine, et remontant l'arrière du réseau sont des fibres d'actine radiales orientées à 90 degrés par rapport au câble d'actine. De façon intéressante, la formation de ces structures d'actine polarisées en réponse à une courbure négative a été observée dans des cellules individuelles et des feuillets cellulaires migrant sur une surface 2D, et dans des cellules intégrées dans des réseaux fibreux 3-D. Alors que ces résultats ont confirmé l'existence de deux mécanismes de migration cellulaire, il y avait encore une question ouverte sur la façon dont les cellules étaient capables de détecter la courbure de l'environnement.
Heureusement, l'imagerie des cellules vivantes a fourni aux chercheurs un indice potentiel :le changement dans la direction du flux d'actine en fonction de la courbure pourrait potentiellement être le « capteur » pour changer le mode de migration. Cela a été confirmé par placage de cellules épithéliales sur une surface à micro-motifs recouverte d'un substrat adhésif, qui était parsemé de patchs circulaires non adhérents. Lorsque la feuille de cellules a rencontré un cercle non adhérent, des protubérances lamellipodiales rampent autour du cercle, tirant les cellules vers l'avant sur le substrat adhésif. Cela a automatiquement créé une forme concave à travers le cercle non adhérent, qui a provoqué un changement rapide dans la direction du flux d'actomyosine de rétrograde à antérograde, résultant en l'assemblage d'un câble d'actine et d'un mécanisme d'interrupteur en migration. Le câble contractile peut soulever le bord de la cellule sur le cercle non adhérent, permettant la poursuite de la migration de la feuille de cellules.
Alors que les cellules contiennent des capteurs de courbure dans leur membrane, telles que les protéines BAR, ceux-ci ne permettent la détection de courbure qu'au niveau moléculaire. Essentiellement, la taille de ces protéines capteurs signifie qu'elles ne peuvent détecter la courbure dans leur voisinage immédiat qu'à l'échelle du nanomètre, pas au niveau de la cellule entière. Cependant, cette étude révèle comment les cellules peuvent détecter des changements de courbure de plus grande taille à une échelle allant jusqu'à des dizaines de micromètres, grâce à une adaptation dynamique du flux d'actine.
Cette capacité permet à la cellule de sélectionner un mécanisme approprié pour poursuivre la migration, même face à divers changements dans l'environnement physique, un peu comme la façon dont un véhicule tout-terrain peut basculer entre deux et quatre roues motrices en fonction du terrain. Avec les nouvelles connaissances de cet interrupteur de débit d'actine, les scientifiques pourraient mieux comprendre comment les cellules peuvent continuer à migrer pendant la cicatrisation des plaies, ou dans des situations où la migration peut être dommageable comme la progression métastatique du cancer.