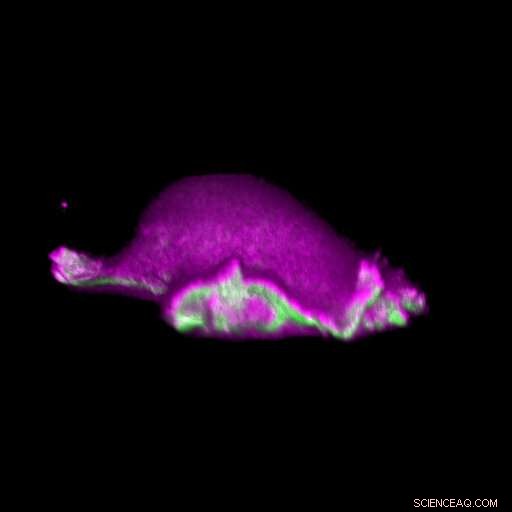
Une cellule avance :les protéines I-BAR (rose) s'accumulent à l'endroit où se courbe son lamellipodium. Ainsi, la cellule peut disposer localement la protéine actine (en vert) et générer un cycle lamellipode. Crédit :Isabell Begemann, Milos Galic
Lorsqu'une cellule individuelle est placée sur une surface plane, il ne reste pas immobile, mais commence à bouger. Ce phénomène a été observé par le biologiste cellulaire britannique Michael Abercrombie dès 1967. Depuis lors, les chercheurs se sont efforcés de comprendre comment les cellules accomplissent cet exploit. C'est bien connu :les cellules forment ce qu'on appelle des lamellipodes – des protubérances cellulaires qui se développent et se contractent continuellement – pour se propulser vers des signaux de signalisation tels que des attractifs chimiques produits et sécrétés par d'autres cellules. Lorsque de tels signaux externes sont manquants, comme dans l'observation d'Abercrombie, les cellules commencent à les rechercher activement. Ce faisant, ils utilisent des modèles de recherche qui peuvent également être observés chez les requins, abeilles ou chiens. Ils se déplacent transitoirement dans une direction, arrêter, se tortiller sur place pendant un moment, puis continuez à vous déplacer dans une autre direction. Mais comment les cellules maintiennent-elles la direction de leur mouvement sur une plus longue période de temps ?
Des chercheurs du pôle d'excellence Cells-in-Motion de l'Université de Münster (Allemagne) rapportent maintenant une réponse à cette question. Ils ont découvert que la géométrie de la membrane peut déclencher des cycles lamellipodes ultérieurs :les forces mécaniques provoquent la génération d'une courbure de la membrane où se rassemblent certaines protéines qui reconnaissent cette géométrie. Ces protéines, à son tour, permettre à la cellule de former les lamellipodes. « La courbure, généré lors de la rétraction prédétermine la croissance du prochain cycle lamellipode. C'est ainsi que le mécanisme se réactive constamment, " explique le biologiste Dr Milos Galic, chef de groupe de recherche junior au Pôle d'Excellence, et auteur principal de l'étude. Lorsque les signaux externes sont manquants, une cellule ne se contente pas de s'arrêter et de marquer le pas, elle se dirige momentanément dans une direction et patrouille efficacement son environnement. L'étude a été publiée dans le Physique de la nature journal.
Le point de départ de l'étude était une observation surprenante faite lors de l'analyse d'images microscopiques. Les chercheurs étudiaient comment les cellules formaient des lamellipodes et, en conséquence, comment le mouvement et la forme des cellules ont changé. Ils ont découvert que les lamellipodes évoluaient sur une large gamme de tailles et avaient des durées de vie très différentes.
« Dans les données, nous ne pouvions reconnaître aucun modèle récurrent dans la croissance et la contraction des lamellipodes, " dit l'auteur principal, le Dr Isabell Begemann, une biologiste qui a réalisé l'étude dans le cadre de sa thèse de doctorat. Les chercheurs ont pu déterminer que les sites d'extension subséquente des lamellipodes se produisaient partout où la membrane cellulaire développait une forte courbure. Ils ont donc émis l'hypothèse qu'un mécanisme lié à ces courbures peut déterminer des cycles de mouvement continu et, en conséquence, persistance du mouvement.
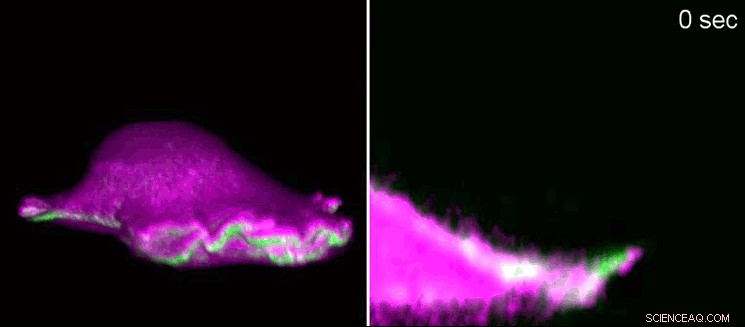
Un fibroblaste de souris avance à l'aide d'un "lamellipodium". À gauche, vue latérale en 3D, sur la droite, une coupe transversale zoomant sur le lamellipode. Les protéines I-BAR (roses) s'accumulent au début du lamellipode du fait de la courbure de la membrane cellulaire. En conséquence, la cellule peut disposer localement la protéine actine (verte) et le lamellipode se développe à nouveau. En utilisant la microscopie à fluorescence en nappe de lumière sur réseau, les chercheurs ont montré les structures minuscules en 3D. Les lamellipodes ont une hauteur de 100 à 200 nanomètres. Crédit :Isabell Begemann, Milos Galic
Biologistes, biochimistes et physiciens ont travaillé en étroite collaboration pour étudier cette idée. Ils ont d'abord développé des biocapteurs afin de marquer des sites très courbés au niveau de la membrane cellulaire, et les visualisés par divers moyens de microscopie à haute résolution. À cette fin, ils ont relié des molécules fluorescentes à des domaines dits I-BAR. Ce sont des régions de protéines en forme de banane dont le côté chargé positivement se lie à la membrane cellulaire chargée négativement, mais uniquement lorsque la membrane est incurvée.
Profitant de ces biocapteurs, les chercheurs ont pu démontrer que les protéines sensibles à la courbure s'accumulent aux endroits où le lamellipode se contracte. Une fois enrichi, ces protéines induisent des forces saillantes dans la cellule via la protéine actine, qui déclenche l'excroissance du lamellipode. Dans une prochaine étape, les chercheurs ont développé un modèle mathématique qui reconstitue le mécanisme et l'a simulé sur ordinateur à l'aide de diverses combinaisons de paramètres. La comparaison des prédictions dérivées du modèle mathématique avec des données d'imagerie expérimentales complémentaires a encore renforcé les résultats trouvés jusqu'à présent.
Les chercheurs ont trouvé des preuves de la présence du mécanisme de motilité identifié dans les modèles de culture cellulaire, par exemple, dans les cellules du tissu conjonctif dérivées de souris, dans les cellules des vaisseaux sanguins humains du cordon ombilical, et aussi dans les cellules immunitaires humaines, c'est-à-dire un type cellulaire qui se déplace en effet librement au sein de l'organisme. Finalement, les chercheurs voulaient également savoir quels effets le mécanisme proposé avait sur le modèle de motilité d'une cellule.
« Nous avons régulé à la baisse les protéines I-BAR, nous permettant de pirater le système d'auto-organisation de la cellule, " dit Milos Galic. Sans le mécanisme, la cellule parvient toujours à se déplacer, mais la zone de recherche devient sensiblement plus petite. Parallèlement à ce mécanisme, il existe d'autres mécanismes qui s'entrelacent, mais le mécanisme a une influence sur le modèle de motilité d'une cellule. Les résultats de l'étude pourraient, à l'avenir, aider à répondre aux questions fondamentales sur les processus dans les organismes impliquant des cellules en mouvement libre.