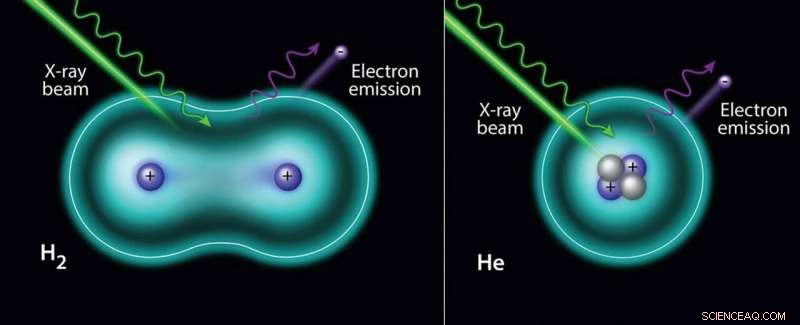
Le faisceau de rayons X induit la photo-éjection d'un électron à partir d'hydrogène (à gauche) et (à droite) d'hélium. Crédit :Département américain de l'énergie
Pour la première fois, des scientifiques ont mesuré la structure vibrationnelle des atomes d'hydrogène et d'hélium par rayons X. Les résultats réfutent l'idée fausse selon laquelle il est impossible d'obtenir des spectres de spectroscopie photoélectronique aux rayons X (XPS) de l'hydrogène et de l'hélium, les deux éléments les plus légers du tableau périodique. On pensait que c'était le cas en raison des faibles probabilités d'éjection d'électrons de ces éléments induites par les rayons X.
Une luminosité de faisceau inégalée à la National Synchrotron Light Source-II augmente considérablement la probabilité qu'un photon entre en collision avec un atome de gaz à des pressions ambiantes. La ligne de lumière permet d'utiliser l'XPS pour étudier directement les deux éléments les plus abondants dans l'univers.
Aussi, ce travail permet de décrire les limites de l'XPS, ouvrant un champ plus large à l'une des techniques les plus utiles en science des matériaux.
La spectroscopie photoélectronique aux rayons X (XPS) est l'une des techniques les plus puissantes de la science des matériaux. Cependant, la littérature est remplie d'affirmations affirmant qu'il est impossible d'utiliser XPS pour étudier les deux éléments les plus légers et les plus abondants de l'univers, l'hydrogène et l'hélium.
Ce travail a démontré que les spectres de photoélectrons X à pression ambiante de l'hydrogène et de l'hélium peuvent être obtenus lorsqu'une source de rayons X suffisamment brillante est utilisée, comme à la National Synchrotron Light Source II.
Dans le cas de l'hélium gazeux, le spectre montre un pic symétrique à partir de sa seule orbitale. Dans le cas des molécules d'hydrogène gazeux, un pic asymétrique est observé, qui est liée aux différents modes vibrationnels possibles de l'état final. La structure vibrationnelle de la molécule d'hydrogène est évidente dans le H 2 Spectre 1s.