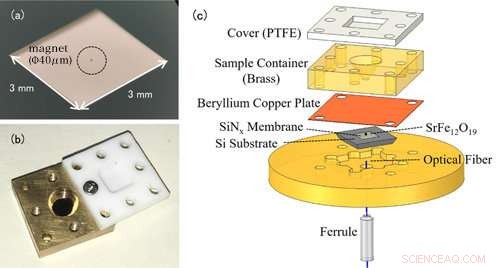
Figure 1 :(a) Photo d'une nanomembrane. La nanomembrane elle-même est très fine (100 nm) et apparaît donc transparente à l'œil nu. L'élément encerclé au centre est un petit aimant pour la détection EPR. (b) Photo de la cellule de solution. Le conteneur est surmonté d'un couvercle en téflon pour empêcher l'évaporation de l'échantillon de solution. (c) La configuration expérimentale de la spectroscopie EPR à détection de force. La cellule de solution contenant l'échantillon de mesure est placée au-dessus de la membrane avec des aimants attachés. Les changements dans la nanomembrane sont détectés par la fibre optique sous la membrane. Crédit :Université de Kobe
Les chercheurs ont développé une nouvelle méthode pour analyser les métalloprotéines avec seulement un petit échantillon liquide. Cette percée a été réalisée par une équipe de recherche dirigée par le professeur agrégé Eiji Ohmichi et Tsubasa Okamoto à la Graduate School of Science de l'Université de Kobe. Les résultats ont été publiés le 28 novembre dans Lettres de physique appliquée .
Les métalloprotéines (également appelées protéines de liaison aux métaux) jouent un rôle vital pour le transport et le stockage de l'oxygène, transport d'électrons, oxydation et réduction. Dans de nombreux cas, les ions métalliques de ces protéines sont les centres actifs de ces activités, donc en identifiant l'état exact de ces ions, nous pouvons comprendre les mécanismes derrière leurs fonctions.
Une méthode expérimentale appelée résonance paramagnétique électronique (RPE) peut être utilisée pour mesurer l'état des ions électroniques dans les protéines. Les techniques EPR efficaces nécessitent une certaine quantité de volume d'échantillon pour des mesures sensibles. Cependant, de nombreuses métalloprotéines sont difficiles à isoler et à raffiner, les chercheurs ne peuvent donc obtenir que de petits échantillons.
Les mesures EPR conventionnelles détectent les ondes électromagnétiques absorbées par les ions métalliques. La caractéristique notable de cette étude est l'utilisation d'un dispositif en forme de trampoline appelé nanomembrane (figure 1(a)). En EPR, le spin de l'électron passe à un état de haute énergie en absorbant des ondes électromagnétiques, mais en même temps, le sens de rotation s'inverse, et les propriétés magnétiques des ions métalliques changent également. Avant l'expérience, l'équipe de recherche a attaché de minuscules aimants à la nanomembrane, ainsi les changements dans la force d'attraction entre les aimants et les ions métalliques sont transformés en une force sur la nanomembrane, et ce signal EPR est détecté. Étant donné que la nanomembrane est très fine, à seulement 100 nm (=0,1 m), nous pouvons mesurer avec sensibilité les petits changements de force qui accompagnent l'absorption EPR.
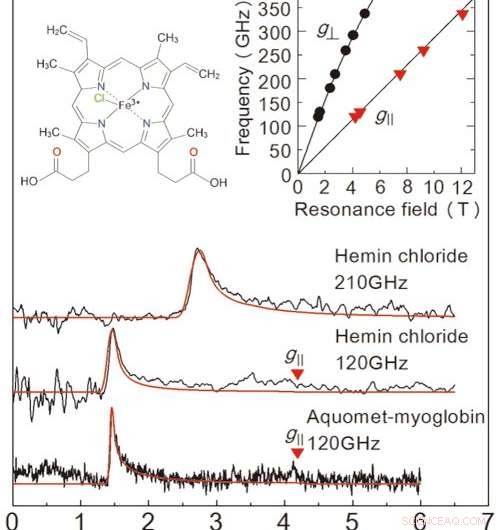
Figure 2 :Résultats des mesures EPR obtenus dans cette étude à partir d'un échantillon de solution congelée. Les deux diagrammes du haut sont pour le chlorure d'hémine, et le graphique en bas est pour la myoglobine. La ligne rouge est un signal projeté à partir d'un simulateur de valeur. Les concentrations de solution et les volumes d'échantillon étaient de 50 mM、2 μL pour le chlorure d'hémine, et 8,8 mM、10 L pour la myoglobine. Les mesures ont eu lieu à 4,2 K. En examinant les deux lignes du graphique en haut à droite, nous sommes en mesure de déterminer l'état exact des ions fer. Le graphique en haut à gauche montre la structure moléculaire du chlorure d'hémine. Crédit :Université de Kobe
L'échantillon de solution est placé dans une cellule de solution directement au-dessus de la membrane (figure 1(b)). Le volume de la cellule n'est que de 50μL (=0,05 cc), et l'équipe ajoute environ 1-10μL (0,001-0,01 cc) de solution pour la mesure. Afin d'éviter l'évaporation de la solution, la cellule est recouverte d'un couvercle en résine. Dans cette méthode, la nanomembrane fine et fragile est indépendante de la cellule de solution, facilitant le changement d'échantillon (figure 1(c)).
Afin d'évaluer les performances de cette configuration, l'équipe a effectué une mesure EPR sur une haute fréquence (supérieure à 0,1 THz) pour une protéine contenant du fer appelée myoglobine et son complexe modèle, le chlorure d'hémine (figure 2). L'équipe a réussi à détecter des signaux EPR sur une large fréquence d'onde (0,1-0,35 THz) pour une concentration de 50 mM, 2μL de solution de chlorure d'hémine. Ils ont également observé un signal EPR caractéristique pour un 8,8 mM, 10μL d'échantillon de solution de myoglobine. Un grand avantage de cette méthode est la capacité de mesurer sur une large gamme de fréquences, le rendant applicable pour les métalloprotéines avec une variété de propriétés magnétiques.
Le professeur Ohmichi commente :« Cette nouvelle méthode permet de déterminer à un niveau détaillé l'état des ions métalliques dans une infime quantité de solution de métalloprotéines. Nous pourrons peut-être appliquer la méthode à des métalloprotéines qui auparavant ne pouvaient pas être mesurées. Par exemple , dans nos métabolismes, une métalloprotéine appelée peroxydase joue un rôle crucial en convertissant le peroxyde d'hydrogène en eau, le rendant inoffensif, mais les détails du mécanisme de ce processus réactif ne sont toujours pas clairs. Les résultats de cette étude peuvent potentiellement être appliqués comme une méthode d'analyse de pointe pour faire la lumière sur ce genre de phénomène vital. »