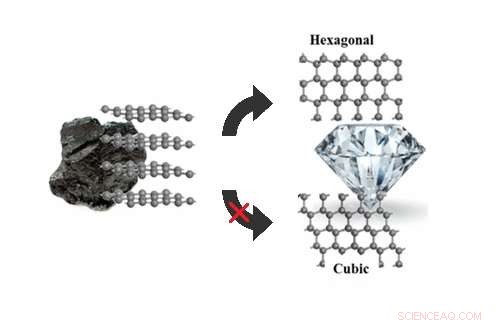
Les simulations stochastiques de marche en surface peuvent expliquer pourquoi le graphite se transforme en hexagone, pas cubique, diamant sous des pressions de 5 à 20 gigapascals. Crédit :Xie et al. ©2017 Société chimique américaine
(Phys.org)—Les chercheurs ont enfin répondu à une question qui a échappé aux scientifiques pendant des années :lorsqu'ils sont exposés à des pressions modérément élevées, pourquoi le graphite se transforme-t-il en diamant hexagonal (également appelé lonsdalite) et non en diamant cubique plus familier, comme le prédit la théorie ?
La réponse se résume en grande partie à une question de vitesse - ou en termes de chimie, la cinétique de la réaction. En utilisant un tout nouveau type de simulation, les chercheurs ont identifié les voies les plus énergétiques dans la transition graphite-diamant et ont découvert que la transition vers le diamant hexagonal est environ 40 fois plus rapide que la transition vers le diamant cubique. Même lorsque le diamant cubique commence à se former, une grande quantité de diamant hexagonal est encore mélangée.
Les chercheurs, Yao-Ping Xie, Xiao Jie Zhang, et Zhi-Pan Liu à l'Université de Fudan et à l'Université de Shanghai à Shanghai, Chine, ont publié leur étude sur les nouvelles simulations de la transition graphite-diamant dans un récent numéro du Journal de l'American Chemical Society .
"Ce travail résout l'énigme de longue date de savoir pourquoi le diamant hexagonal est préférentiellement produit à partir de graphite au lieu du diamant cubique au début de la formation du diamant, " Liu a dit Phys.org . « Considérant que le graphite-diamant est un prototype de transition solide-solide, les connaissances acquises grâce à ce travail devraient grandement profiter à la compréhension de la physique et de la chimie des solides à haute pression."
Graphite, diamant hexagonal, et le diamant cubique sont tous des allotropes de carbone, ce qui signifie qu'ils sont constitués d'atomes de carbone qui sont disposés de différentes manières. Le graphite est constitué de couches empilées de graphène, dont les atomes sont disposés en un réseau en nid d'abeille. Étant donné que les atomes de carbone du graphène ne sont pas entièrement liés, le graphène est doux et s'écaille facilement, le rendant idéal pour une utilisation comme mine de crayon.
Les deux types de diamant, d'autre part, se composent d'atomes de carbone qui ont tous le maximum de quatre liaisons, ce qui explique pourquoi le diamant est si dur. En diamant cubique (le genre que l'on trouve généralement dans les bijoux), les couches sont toutes orientées dans la même direction. En diamant hexagonal, les couches sont orientées alternativement, lui donnant une symétrie hexagonale.
Sous de hautes pressions de plus de 20 gigapascals (près de 200, 000 fois la pression atmosphérique), la théorie et l'expérience s'accordent pour dire que le graphite se transforme en diamant cubique, avec du diamant hexagonal mélangé. Mais sous des pressions de moins de 20 gigapascals, les simulations ont toujours prédit que le diamant cubique devrait être le produit privilégié, contrairement aux expériences.
Ces simulations sont basées sur la prédiction que, à ces pressions, moins d'énergie est nécessaire pour former le noyau de nucléation de diamant cubique, ou noyau - le point de départ de la croissance du diamant - que de former le noyau de diamant hexagonal. Étant donné que la formation de ce noyau est l'étape la plus énergivore de l'ensemble du processus, il s'ensuit que la formation de diamant cubique devrait être plus favorable du point de vue thermodynamique que le diamant hexagonal.
Mais un inconvénient majeur de ces simulations est qu'elles ne tiennent pas compte des interfaces entre le graphite et les noyaux de diamant :un décalage de maille entre les deux surfaces peut induire une énergie de déformation qui peut interférer avec la stabilité du diamant en croissance.
À l'aide d'une nouvelle simulation appelée marche de surface stochastique, les chercheurs de la nouvelle étude pourraient explorer plus en détail toutes les interfaces possibles et en identifier sept qui correspondent aux structures intermédiaires de plus basse énergie dans la transition graphite-diamant.
Globalement, les résultats montrent que l'interface entre le graphite et le noyau de diamant hexagonal est moins contrainte et plus stable que l'interface avec le noyau de diamant cubique. La prise en compte de la stabilité de ces interfaces peut enfin expliquer pourquoi le diamant hexagonal se forme beaucoup plus facilement et rapidement que le diamant cubique à des pressions modérées.
Les chercheurs ont ajouté que, bien que le diamant cubique puisse sembler plus souhaitable que le diamant hexagonal pour la personne moyenne, les deux matériaux ont leurs avantages.
"Alors que le diamant cubique est familier dans la vie quotidienne et est un matériau très utile, le diamant hexagonal pourrait aussi être très utile, " dit Liu. " Par exemple, il a été prédit par la théorie d'être encore plus dur que le diamant cubique. Alors que le diamant hexagonal (lonsdaléite) peut être trouvé dans les météorites, la production de gros cristaux de diamant hexagonaux n'a pas été réalisée expérimentalement. On s'attendrait donc à ce que de gros cristaux de diamant hexagonaux, s'il est produit, serait encore plus précieux qu'un diamant cubique."
À l'avenir, les chercheurs prévoient d'améliorer encore les simulations en incorporant des techniques de réseaux de neurones ainsi qu'en utilisant les mégadonnées.
© 2017 Phys.org