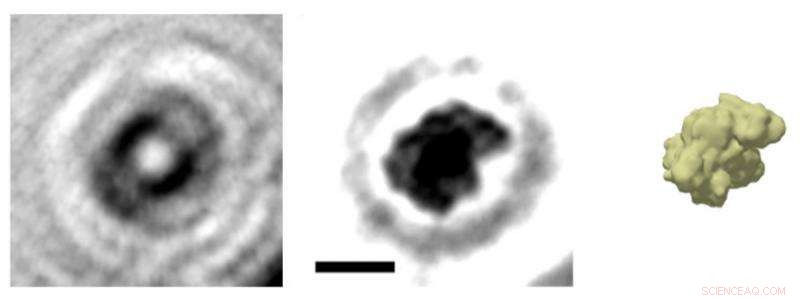
Une image holographique d'une seule protéine :L'image de la protéine albumine (au centre) est calculée à partir de l'hologramme (à gauche). En principe, c'est comme si l'on traçait les vagues générées par une pierre jetée dans l'eau afin de reconstituer la forme de la pierre. Comme le montre une comparaison avec une simulation de densité électronique, la représentation holographique reproduit très fidèlement la structure globale de la protéine. Crédit :Jean-Nicolas Longchamp / Université de Zurich
Les protéines sont les outils de la vie. Dans le futur, les scientifiques peuvent être en mesure d'examiner des molécules individuelles avec une méthode particulièrement douce pour déterminer comment elles sont construites, comment ils remplissent leurs fonctions dans les cellules, et comment ils interagissent avec les médicaments potentiels. Ceci est possible grâce aux hologrammes de protéines qui, pour la première fois, ont été produites à l'aide d'électrons très lents par des scientifiques de l'Université de Zurich et de l'Institut Max Planck pour la recherche sur l'état des solides à Stuttgart.
Connaître la structure des protéines intéresse non seulement les biologistes qui veulent comprendre le fonctionnement d'un organisme mais aussi les médecins et les pharmacologues qui ont besoin de savoir comment sont construites les protéines, comment ils interagissent avec d'autres protéines et molécules plus petites, et comment ces sites de liaison changent à mesure que la protéine remplit ses fonctions. Avec cette connaissance, les chercheurs peuvent développer des médicaments qui interagissent avec la machinerie protéique lorsqu'elle se dégrade et que nous tombons malades.
La capacité d'imager des protéines uniques pourrait être extrêmement utile :les méthodes courantes telles que l'analyse de la structure aux rayons X et la microscopie cryoélectronique nécessitent des cristaux des biomolécules ou une grande quantité d'une protéine. Une lacune de ces méthodes est que les cristaux de nombreuses protéines sont impossibles à faire croître. De plus, en raison de la moyenne, les techniques échouent souvent à détecter les différences entre les diverses conformations, c'est-à-dire des variantes structurelles, de la biomolécule. Or ce sont précisément ces variations qui sont importantes dans la recherche de nouveaux médicaments, car les protéines prennent diverses conformations lorsqu'elles remplissent leurs fonctions.
L'idée originale de l'holographie est maintenant réalité
« Nous avons maintenant imagé des protéines uniques pour la première fois, " dit Hans-Werner Fink, professeur à l'Université de Zurich et responsable de l'expérience. « Cela a été réalisé en combinant deux méthodes uniques dans le monde scientifique :l'holographie électronique et le dépôt par faisceau d'ions électrospray, ce qui permet de préparer les échantillons très doucement. » En utilisant cette combinaison, les chercheurs ont généré des hologrammes du cytochrome C, albumine et hémoglobine. Comme les structures de ces protéines sont déjà connues, les chercheurs ont pu les utiliser pour confirmer l'exactitude et l'utilité des hologrammes.
Pour l'holographie électronique, les chercheurs du groupe zurichois de Hans-Werner Fink ont mis au point un microscope innovant qui exploite les propriétés ondulatoires des électrons. Le microscope émet des électrons de faible énergie à travers une protéine et superpose les électrons diffusés avec la partie du faisceau d'électrons qui n'a pas interagi avec la protéine. La figure d'interférence résultante, qui peut être enregistré par le microscope, forme un hologramme similaire à ceux obtenus par holographie optique. "Parce que les électrons ont très peu d'énergie, il y a très peu de dommages dus aux radiations, même si nous imaginons une protéine pendant des heures, contrairement aux autres méthodes d'analyse structurelle, " explique Hans-Werner Fink.
Avec le microscope holographique électronique, le physicien a réalisé l'idée originale de Dennis Gábor. Lorsque l'ingénieur hongrois-britannique a inventé l'holographie en 1947, il avait en fait en tête un microscope électronique amélioré. Cependant, à l'époque, il n'y avait pas de sources d'électrons appropriées, pour que, suite à l'invention du laser, ce nouveau principe d'imagerie optique ne pouvait être mis en pratique qu'avec la lumière. Dennis Gábor a reçu le prix Nobel de physique en 1971. "Après l'invention d'une source ponctuelle d'électrons ultra-aigus, qui émet des électrons aux propriétés similaires à une lumière laser, nous avons finalement réalisé l'idée géniale de Dennis Gábor avec les ondes électroniques, " dit Hans-Werner Fink.
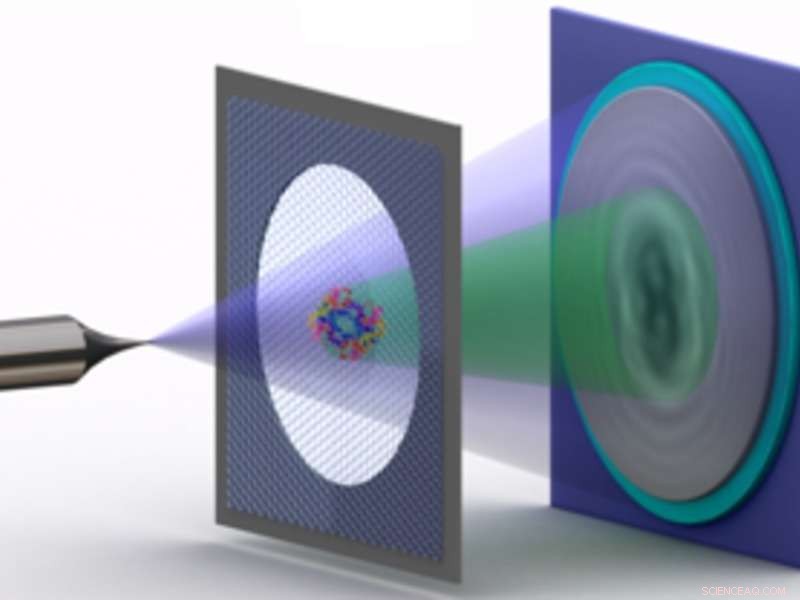
Schéma montrant l'holographie électronique de protéines uniques :une pointe métallique dont l'extrémité se rétrécit à quelques atomes seulement émet un faisceau de relativement lent, c'est à dire., électrons de faible énergie. Une partie du faisceau est diffusée par la protéine sur un support de graphène. La partie diffusée du faisceau génère alors une figure d'interférence avec la partie non diffusée - l'hologramme - qui est enregistrée. Crédit :Tatiana Latychevskaia /Université de Zurich
La protéine gazeuse est doucement placée sur le graphène
Cependant, imager des protéines uniques par holographie électronique, les chercheurs suisses avaient encore besoin d'un matériau porteur pour les protéines qui soit transparent aux ondes électroniques ainsi que d'une méthode pour y placer des biomolécules sans causer de dommages. Le graphène s'est avéré être le matériau le plus approprié pour le support. Des chercheurs du Max Planck Institute for Solid State Research ont trouvé la meilleure solution pour déposer des protéines sur les feuillets constitués de couches de carbone :dépôt par faisceau d'ions électrospray, qui a été développé par une équipe dirigée par Stephan Rauschenbach dans le département de Klaus Kern. Les chercheurs exposent la solution de protéines à une tension électrique élevée afin que le liquide soit fortement chargé. La répulsion électrique provoque alors l'atomisation du liquide en une fine brume. Lorsque les gouttelettes de brume sont exposées au vide, le liquide s'évapore et les constituants dissous, c'est-à-dire les protéines et les impuretés, restent en arrière sous forme de gaz. Un spectromètre de masse trie ensuite les protéines en fonction de leur rapport masse/charge et sépare également les impuretés.
"Notre méthode permet de transférer des molécules biologiques uniques dans le vide et de les déposer sur une surface si doucement que leur fragile structure protéique repliée en trois dimensions est préservée, " explique Stephan Rauschenbach. " Grâce à la spectrométrie de masse préparative, nous évitons également la contamination des échantillons de graphène par d'autres molécules, ce qui est crucial pour la qualité de l'image holographique." La spectrométrie de masse permet également de séparer des mélanges de protéines ou des protéines pures à partir de complexes avec des partenaires de liaison.
Informations sur l'assemblage des sous-unités
Une fois que Stephan Rauschenbach et ses collègues ont déposé les protéines sur les substrats de graphène à Stuttgart, les échantillons doivent être transportés à Zurich, où se trouve le microscope holographique électronique. Les échantillons doivent arriver dans un état non contaminé, ce qui signifie qu'aucune autre molécule ne peut se déposer sur le graphène. Pour transporter les échantillons en Suisse, les chercheurs ont développé un cas dans lequel règne un ultra-vide, comme dans l'appareil lui-même.
Grâce notamment au soin méticuleux et à la propreté observés lors de la préparation et du transport des échantillons, les hologrammes électroniques atteignent déjà une résolution de moins d'un nanomètre. "Cela nous permet d'étudier comment les sous-unités individuelles de grands complexes protéiques sont assemblées, ", explique Stephan Rauschenbach. Les premiers hologrammes de protéines individuelles fournissent également des informations sur leur structure tridimensionnelle.
"Toutefois, imager avec précision les structures protéiques au niveau atomique, nous devons encore améliorer quelque peu la résolution, " explique Klaus Kern. ", il n'y a aucun obstacle physique empêchant cela. » Les scientifiques basés à Zurich et à Stuttgart prévoient maintenant de construire un microscope dans lequel les vibrations des protéines sont supprimées en refroidissant les échantillons à environ moins 200 degrés Celsius. De plus, un laboratoire de précision unique a récemment été construit à l'institut Max Planck de Stuttgart, qui offre des conditions parfaites pour des mesures très sensibles telles que l'holographie. Ce laboratoire a été construit à l'initiative de Klaus Kern et est actuellement l'étalon-or pour un environnement de mesure à faibles vibrations. Dès que le microscope holographique électronique a été optimisé, les scientifiques biomédicaux peuvent utiliser ce nouvel instrument pour étudier les subtilités du fonctionnement des outils de la vie.