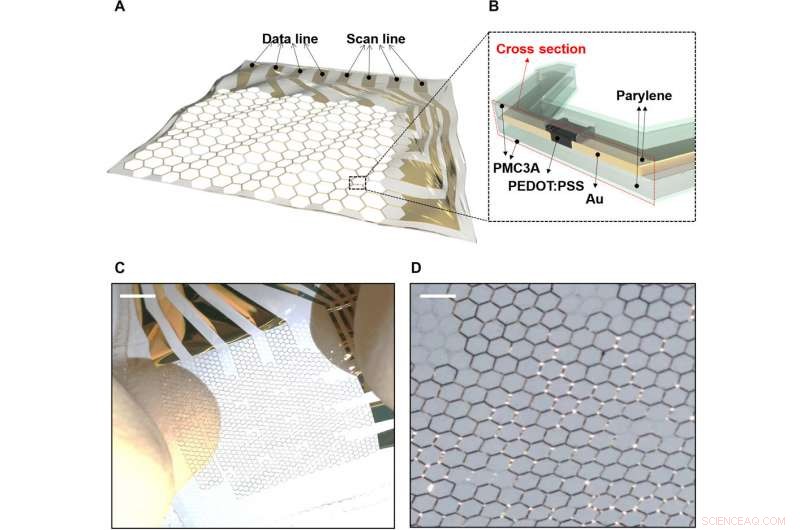
Réseau OECT extensible sur substrat de grille en nid d'abeille. A) La matrice OECT électrophysiologique étirable sur un substrat de parylène à grille en nid d'abeille. B) Coupe transversale du réseau OECT extensible. C) Un réseau OECT extensible 4 x 4 lorsqu'il est intrinsèquement étiré. D) Vue agrandie d'une matrice OECT extensible 4 x 4 lorsqu'elle est étirée. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aau2426
Pour évaluer les fonctions physiologiques in vivo, les signaux électrophysiologiques doivent être surveillés avec une grande précision et une haute résolution spatiale ou temporelle. Ultraflexible, des réseaux multiélectrodes (AME) ont été récemment fabriqués pour établir un contact conforme sur les surfaces des organes et pour mesurer la propagation du signal électrophysiologique à haute résolution spatio-temporelle. Cependant, les substrats en plastique avec un module de Young élevé incorporés dans le processus ont causé des difficultés lors de l'implantation en raison de l'hémodynamique dynamique basée sur le mouvement à la surface du cœur. Dans une nouvelle étude publiée dans Avancées scientifiques , Wonryung Lee et ses collègues ont développé un AME actif fabriqué pour démontrer la non-thrombogénicité, extensibilité et stabilité. Les réseaux ont permis une surveillance électrocardiographique (ECG) à long terme dans le cœur battant des rats, même en cas de saignement capillaire. Les signaux ECG mesurés présentaient un rapport signal sur bruit (SNR) élevé de 52 dB en raison de la lecture active des données.
Dans l'étude, le nouveau MEA extensible a été soigneusement conçu en utilisant des techniques d'ingénierie de pointe. Les méthodes combinaient des transistors électrochimiques organiques (OECT) à gain extraordinairement élevé traités sur des substrats de microgrille avec un revêtement en poly(3-méthoxypropylacétate) (PMC3A). Le procédé a facilité des propriétés antithrombotiques significatives tout en maintenant une excellente conductivité ionique.
Typiquement, des réseaux multiélectrodes (MEA) sont utilisés pour étudier la position des cellules actives/inactives, propagation de signaux neuronaux et mise en réseau entre plusieurs neurones. Les réseaux peuvent également être utilisés pour diagnostiquer et traiter une maladie en mesurant des signaux biologiques en plusieurs points. Le premier MEA in vitro rapporté a été fabriqué sur du verre plat pour mesurer l'excitation cellulaire dans le myocarde en culture, cellules neuronales et propagation du signal à partir de tranches de cœur et de cerveau. Les puces MEA in vivo non invasives récemment développées ont été fabriquées sur une feuille de plastique flexible avec la capacité d'entrer en contact avec des tissus vivants mous et en mouvement. Au cours du processus d'ingénierie, la flexibilité du dispositif doit être augmentée pour faciliter les AME sur des structures complexes dans le corps pendant l'implantation.
Contact conforme sur les surfaces cérébrales ridées, par exemple, peut être obtenu en réduisant l'épaisseur du dispositif en dessous de deux µm. De la même manière, Les mesures ECG peuvent être effectuées sur la peau près du cœur via des AME passifs sur des substrats en polyimide de 3 µm. Les propriétés ultraflexibles des AME actifs ont été démontrées par un contact en douceur avec les cellules musculaires, cortex cérébral ainsi que des mesures d'électromyographie (EMG) et d'électrocorticographie (ECoG). Un MEA actif extensible et compatible avec le sang n'a pas encore été réalisé en raison de deux limitations principales. Au début, une dégradation du dispositif due à des caillots sanguins dus à des saignements chirurgicaux en raison d'un module de Young élevé a été observée avec des polymères de polyimide ou de parylène malgré leur haute compatibilité. Après, il est également difficile de concevoir des éléments actifs à hautes performances et extensibles pour mesurer les signaux biologiques. Les éléments actifs nécessitaient également des facteurs d'amplification élevés et de faibles tensions de commande.
Dans l'étude, Lee et al. conçu un ultra-mince, matrice active OECT (transistor électrochimique organique) extensible à motif de grille pour mesurer la distribution des signaux ECG avec un rapport signal sur bruit (SNR) de 52 dB via un contact direct sur le cœur battant du rat. Le réseau actif 4 x 4 OECT a été fabriqué avec une épaisseur totale de 2,6 µm et une transconductance élevée. Le dispositif a été entièrement recouvert de poly(acétate de 3-méthoxypropyle) (PMC3A) de 100 nm d'épaisseur pour conférer des propriétés antithrombotiques tout en maintenant une excellente conductivité ionique. Un ECG a été cartographié à partir de la surface du cœur d'un rat pour déterminer la faisabilité du 4 x 4, très mince, extensible, puce OECT antithrombotique et active. En raison de la conformabilité élevée de la structure de la grille, le bruit d'artefact causé par le mouvement dynamique n'apparaissait pas dans les données enregistrées. En outre, en raison de sa propriété antithrombotique, l'appareil était capable d'effectuer des mesures stables sur de longues périodes de temps, même dans un environnement d'implant avec un saignement constant.
Le MEA étirable contenant des OECTS et des substrats de grille ont été fabriqués sur des substrats de parylène de 1,2 µm. Les couches actives d'un poly(3, Le système de 4-éthylènedioxythiophène)polystyrène sulfonate (PEDOT:PSS) et le câblage ont été réalisés sur un substrat de grille en nid d'abeille. La structure de grille en nid d'abeille a permis la stabilité mécanique et l'extensibilité structurelle, précédemment étudié expérimentalement et par simulation. La couche la plus externe de PMC3A [poly(acétate de 3-méthoxypropyle)] a permis une compatibilité sanguine élevée pour maintenir l'antithrombogénicité. L'extensibilité du dispositif a permis un mouvement dynamique sur des substrats biologiques.
Avant de mener des expériences biologiques in vivo, les auteurs ont systématiquement évalué le caractère électrique et mécanique du dispositif. Les performances électriques ont été mesurées par rapport à la transconductance du réseau, qui indiquait des quantités suffisamment importantes pour mesurer les signaux ECoG ou EMG des rats. L'épaisseur et l'angle de contact avec l'eau des surfaces PMC3A ont montré des résultats cohérents avec les études précédentes. Des études d'hémocompatibilité sur PMC3A ont été menées en utilisant l'adhésion plaquettaire en trempant des échantillons dans des suspensions de plaquettes extraites de sang humain. Le temps de réponse (τ) des OECT avant et après le revêtement PMC3A a été mesuré après l'application d'une impulsion de tension de grille d'une durée d'une milliseconde, indiquant que le processus de trempage du PMC3A n'a pas modifié les propriétés électriques de l'OECT. Les PMC3A revêtus d'OECT ont également confirmé la stabilité électrique à long terme.
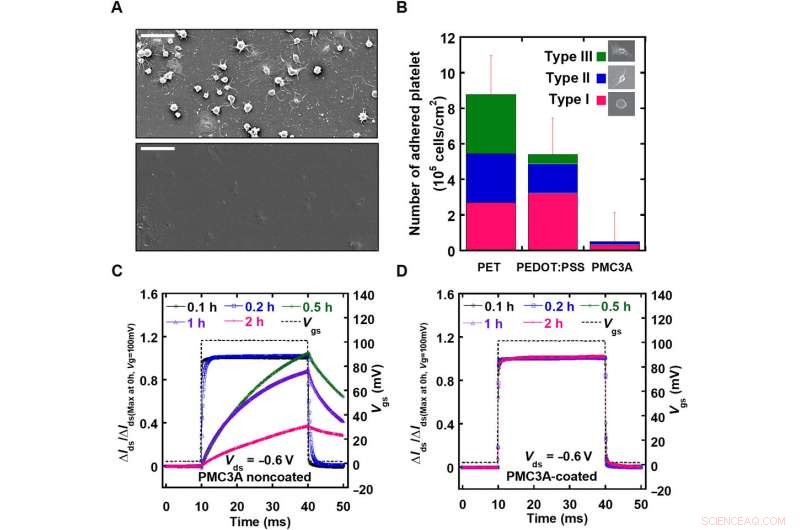
Évaluation de la compatibilité sanguine du revêtement PMC3A sur les OECT. A) L'image SEM du polyéthylène téréphtalate (PET) et du film revêtu de PMC3A observé après 1 heure d'adhésion plaquettaire. B) Le nombre moyen de plaquettes collées sur film PET par rapport aux films PEDOT:PSS et PMC3A après 1 heure d'adhésion plaquettaire. C) Après adhésion des plaquettes avec des temps d'adhésion de 0,1 à 2 heures, les valeurs des OECT avec ou sans revêtement PMC3A ont été mesurées en appliquant une impulsion de tension de grille d'une durée de 50 ms. D) Une excellente compatibilité avec le sang de surface a permis une surveillance du signal ECG à long terme. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aau2426
Les chercheurs ont ensuite mené des études in vivo dans un modèle de rat dans lequel la faisabilité des matrices OECT étirables et hémocompatibles a été réalisée via des mesures ECG sur les surfaces cardiaques. Les signaux physiologiques ont été mesurés à l'aide du réseau 4 x 4 d'OECT extensibles et hémocompatibles en les attachant à la surface exposée du cœur. Les trous en nid d'abeille dans le substrat ultramince ont permis un contact conforme entre le film du dispositif et la surface du cœur.
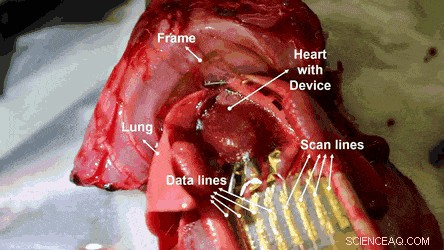
Cartographie électroanatomique sur une surface cardiaque à l'aide de MEA active sur le substrat de grille en nid d'abeille ultrafin. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aau2426
Le rapport signal sur bruit de l'OECT revêtu de PMC3A enregistré à 51 dB 30 min après la fixation était similaire à la valeur enregistrée juste après la fixation. L'ordre de millisiemens de transconductance observé dans l'étude était dû à la perméabilité à l'eau du PEDOT:PSS. Par conséquent, la transconductance de l'OECT était 100 fois plus élevée que celle des transistors à effet de champ (FET) Si.
Les chercheurs ont également démontré des signaux de cartographie ECG à l'aide de la matrice OECT lorsque l'appareil a été placé sur une surface cardiaque de rat couvrant les zones des ventricules gauche et droit. L'impédance de charge a été conçue pour être de 0 ohm pour supprimer considérablement la diaphonie dans le réseau OECT comme démontré précédemment. Des cartes spatiales de tension de tous les nœuds à quatre moments séquentiels ont été visualisées. En fonction de l'emplacement du capteur, les signaux anatomiques montraient des formes différentes. Les matrices OECT extensibles et compatibles avec le sang ont enregistré avec succès la distribution spatio-temporelle des ECG sur les surfaces cardiaques de rat avec multiplexage.
La cartographie électroanatomique sur une surface cardiaque par multiplexage. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aau2426
Dans l'étude, un SNR élevé de 52 dB a été obtenu pour deux raisons ; premier, puisque les auteurs ont réussi à utiliser des OECT avec une transconductance élevée de l'ordre du millisiemen. Supérieur d'un facteur 10 par rapport au Si FET monocristallin en présence de saignement chirurgical, tandis que le revêtement PMC3A maintenait simultanément une conductivité ionique élevée. Seconde, le bruit d'artefact de mouvement a été supprimé par la haute conformabilité de l'architecture microgrid :le dispositif peut adhérer à la cible dynamique pendant le mouvement du cœur. Les MEA étirables et actifs avec revêtement PMC3A non thrombogène permettront des mesures d'ECG, Signaux ECoG ou EMG avec une plus grande précision dans d'autres études précliniques.
© 2018 Réseau Science X