Les peptides sont des biomolécules formées lorsque deux ou plusieurs acides aminés qui remplissent des fonctions clés dans l'organisme humain, tels que les hormones, les neurotransmetteurs, les analgésiques et les antibiotiques, se lient. C'est pour cette raison qu'ils sont très étudiés et utilisés par l'industrie pharmaceutique, par exemple.
Une étude menée par des scientifiques du Département de biophysique de la Faculté de médecine de l'Université fédérale de São Paulo (EPM-UNIFESP) au Brésil a identifié des changements significatifs dans les propriétés physicochimiques des peptides au cours d'un processus spontané de changement chimique appelé pyroglutamination.
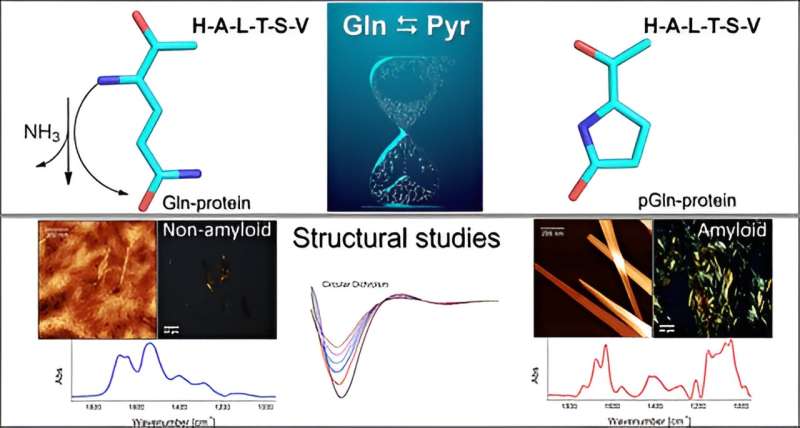
La pyroglutamination est une modification résultant de la conversion spontanée de la glutamine en acide pyroglutamique, ayant un impact significatif sur les propriétés physiques et chimiques des peptides. Il s'agit d'un élément bien connu mais souvent négligé de la synthèse peptidique et rarement exploré en protéomique.
Les chercheurs qui ont mené l'étude soulignent que cela peut se produire rapidement et s'accélérer à mesure que la température augmente, soulignant la nécessité d'être prudent lors des expériences en laboratoire pour empêcher la cyclisation de la glutamine. C'est particulièrement important dans des conditions qui imitent les environnements physiologiques où les températures sont de l'ordre de 37°C, la température normale d'un organisme humain en bonne santé.
La découverte a des implications pour la recherche en laboratoire et ouvre de nouvelles perspectives pour l'étude des maladies neurodégénératives telles que la maladie d'Alzheimer et la maladie de Parkinson, car après modification chimique, la molécule acquiert une structure amyloïde, qui favorise l'agrégation des molécules, formant des plaques comme celles censées causer les maladies. en question.
Un article sur l'étude est publié dans Biochemistry .
Le groupe a mené des expériences in vitro pour étudier le mécanisme par lequel l'acide aminé glutamine (Gln) devient de l'acide pyroglutamique (Pyr) en présence d'une séquence peptidique ou protéique à l'extrémité N-terminale. Ce processus se produit par désamidation, une réaction qui élimine l'ammoniac (NH3 ). Le Pyr (également appelé pyroglutamate) est un acide aminé cyclique formé à la suite de la déshydratation du glutamate. Toutes les protéines sont constituées de plusieurs acides aminés reliés entre eux par des liaisons peptidiques, avec des variations dans le nombre et la séquence des acides aminés.
"Le résultat peut servir de modèle à de nombreux chercheurs qui travaillent avec des peptides. Nous sommes arrivés à deux conclusions clés. Nous sommes revenus à un vieux sujet, à savoir comment la glutamine se décompose en acide pyroglutamique, mais nous avons introduit un avertissement sur l'importance d'analyser la séquence. Le deuxième point était qu'après la conversion du peptide, ses caractéristiques changent et il a tendance à coller aux membranes."
"La présence d'acide pyroglutamique favorise la formation d'agrégats amyloïdogènes, semblables aux conglomérats que l'on trouve généralement dans les cas de maladies neurodégénératives. Ces plaques amyloïdes se forment dans le cerveau et interrompent le flux des neurones", a déclaré Clovis Ryuichi Nakaie, dernier auteur de l'étude. article.
La séquence peptidique modèle (QHALTSV-NH2) utilisée dans l'étude provient du doctorat. recherches de Mariana Machado Leiva Ferreira, premier auteur de l'article, alors qu'elle cherchait une synthèse d'une vingtaine de peptides présents dans les séquences de cinq récepteurs couplés aux protéines G (GPCR) dont la taille variait jusqu'à environ 20 acides aminés. Les GPCR capturent un large éventail de signaux extracellulaires (allant des photons aux ions, protéines, neurotransmetteurs et hormones) et activent les voies de signalisation à l'intérieur des cellules.
L'un des peptides synthétisés par Ferreira se distinguait par son faible rendement et était le seul à contenir de la glutamine à son extrémité amine. "Après la première tentative de synthèse avec un très faible rendement, nous avons fait varier plusieurs paramètres pour augmenter la production du peptide, y compris des modifications de la partie synthétique et du processus de purification, mais malheureusement il s'est toujours partiellement dégradé", a-t-elle déclaré.
Lorsque le groupe a testé des solutions fréquemment utilisées dans des expériences protéomiques, ils ont constaté que la conversion de la glutamine en acide pyroglutamique se produisait dans chacune d'elles en fonction du temps, conformément à une cinétique typique de premier ordre, où le taux de conversion était proportionnel au temps nécessaire. par la réaction. Ils ont alors décidé de ne pas agiter la solution afin de pouvoir en déduire le taux de conversation. Par exemple, ils ont estimé qu'après cinq heures, au moins 10 % de la glutamine était probablement convertie en acide pyroglutamique.
Un changement structurel mineur déclenché lorsque le peptide natif a été pyroglutaminé à l'extrémité N-terminale a suffi à modifier le comportement physico-chimique de la molécule.
"Parce qu'il est cyclique et possède une charge positive de moins, le peptide Pyr devrait être plus hydrophobe que la molécule native, et nous nous attendions donc à ce que l'analogue interagisse avec les systèmes mimétiques membranaires. Ce que nous n'avions pas prévu, c'est que l'analogue entraînerait la formation de structures amyloïdes comme celles observées dans les maladies neurodégénératives. Nous n'avons étudié aucune d'entre elles, mais nos résultats vont dans cette direction", a déclaré à l'Agence FAPESP Emerson Rodrigo da Silva, avant-dernier auteur de l'article. Silva et Nakaie sont les auteurs correspondants.
Nakaie a souligné l'importance des changements post-traductionnels dans l'organisme impliquant la chaîne polypeptidique. Ils jouent un rôle dans la diversité fonctionnelle des protéines et permettent d'adapter une séquence d'acides aminés codée par un gène pour remplir diverses fonctions régulatrices.
"Dans ce contexte, le temps en tant que facteur sera toujours en corrélation avec l'apparition de changements, quelle que soit leur vitesse ou leur localisation dans notre organisme. Cela rappelle l'idée de l'horloge biologique et c'est la raison pour laquelle nous avons suggéré de mettre un sablier sur la couverture. du journal pour symboliser la conversion spontanée de Gln en Pyr", a déclaré Nakaie.
Il est professeur à l'EPM-UNIFESP depuis 45 ans et a souligné le travail révolutionnaire réalisé par le groupe du Département de biophysique. En particulier, a-t-il noté, ils ont introduit la synthèse et la biochimie des peptides et des dérivés d'acides aminés au Brésil.
"Nos résultats ouvriront sans aucun doute la voie à d'autres études. Après avoir terminé les travaux dont faisait partie la recherche doctorale de Mariana Ferreira, nous souhaitons également poursuivre cette ligne de recherche", a-t-il déclaré.
Plus d'informations : Mariana M. L. Ferreira et al, Modifications induites par la pyroglutamination dans les caractéristiques physicochimiques d'un peptide de chimiokine CXCR4 :analyse cinétique et structurale, Biochimie (2023). DOI :10.1021/acs.biochem.3c00124
Informations sur le journal : Biochimie
Fourni par FAPESP