Un grand nombre d’applications dans l’industrie chimique reposent sur les molécules NADH ou NADPH comme carburant. Une équipe dirigée par le professeur Dirk Tischler, chef du groupe de travail sur la biotechnologie microbienne à l'université de la Ruhr à Bochum, a utilisé un biocatalyseur pour étudier leur production en détail.
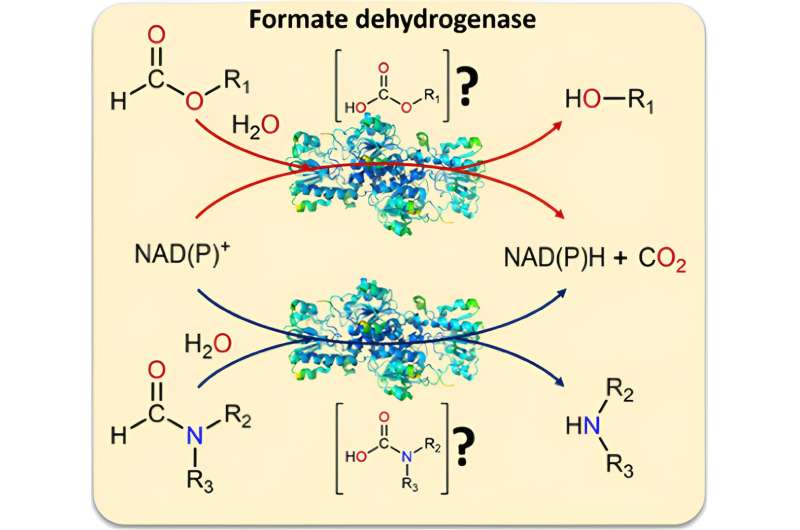
Les chercheurs ont prouvé qu’en plus du formiate, la formiate déshydrogénase, un biocatalyseur, peut également convertir les formamides. Cela signifie, d’une part, que l’enzyme peut également couper la liaison C-N difficile à rompre. D'autre part, les formamides sont un solvant courant.
"Cela ouvre des possibilités complètement nouvelles pour les réactions NADH peu solubles ainsi que pour les réactions dépendantes du NADPH", explique Tischler.
Les chercheurs ont publié leurs résultats dans la revue ACS Catalysis. le 26 janvier 2024.
La formiate déshydrogénase est utilisée dans les processus biocatalytiques pour rendre les électrons disponibles comme carburant pour d'autres réactions en les éliminant d'un substrat. Dans les applications actuelles, le substrat est le NAD+ et le produit est le NADH. Le déchet est du CO2 .
"C'est une bonne chose dans ce cas, car il s'échappe sous forme de gaz et empêche ainsi la réaction souhaitée de se produire", explique Tischler.
Comme la variante NADPH, avec un groupe phosphate supplémentaire, est souvent requise comme produit, son équipe a créé des mutants du biocatalyseur qui convertit le NADP+ en produit souhaité.

Et si le catalyseur rompait également la liaison C-N ?
En travaillant sur la formiate déshydrogénase, les chercheurs ont réalisé que l’on savait peu de choses sur les matières premières alternatives pour le biocatalyseur. "Nous avons examiné différents substrats possibles (dérivés du formiate) et avons constaté qu'une liaison C-O est toujours rompue lorsqu'ils sont convertis par le biocatalyseur", explique Tischler. "Cela nous a donné une idée :et si l'enzyme pouvait également cliver les liaisons C-N, une tâche traditionnellement difficile à résoudre ?"
D'autres tests ont montré que le biocatalyseur en est effectivement capable :il peut également transformer les formamides, des dérivés du formiate avec un composé supplémentaire, pour former de l'azote, comme matière première. Les formamides étant des solvants courants et peu coûteux, ils servent à la fois de solvant et de substrat dans cette réaction. Il est également possible de fournir du NADH et du NADPH dans cette constellation. CO2 est également produit comme déchet dans ces réactions et, en s'échappant, empêche les réactions de revenir en arrière.
"Cette réaction n'a jamais été décrite auparavant", explique Tischler. Son équipe a montré que l'utilisation des formamides comme source d'électrons pour la formation de NADPH peut obtenir des résultats équivalents, voire légèrement meilleurs, par rapport au système conventionnel avec formiate.
"Cela ouvre de toutes nouvelles possibilités, car nos mutants les plus stables sont toujours actifs dans jusqu'à 40 % en volume des formamides", explique le chercheur.
Plus d'informations : Artur Maier et al, Ouvrir la diversité catalytique d'une formiate déshydrogénase :activité formamide pour la régénération du NADPH et approvisionnement en amine pour l'amination réductrice asymétrique, Catalyse ACS (2024). DOI :10.1021/acscatal.3c05409
Informations sur le journal : Catalyse ACS
Fourni par Ruhr-Universitaet-Bochum