Des chercheurs de l'Université du Michigan célèbrent la découverte d'une nouvelle biochimie végétale et de sa capacité inhabituelle à former des peptides cycliques, des molécules prometteuses dans les produits pharmaceutiques car elles peuvent se lier à des cibles médicamenteuses difficiles.
Les peptides cycliques constituent un domaine émergent et prometteur de la recherche sur les médicaments.
La nouvelle étude, dirigée par Lisa Mydy et Roland Kersten, chercheurs de l'UM College of Pharmacy, a révélé un mécanisme par lequel les plantes génèrent des peptides cycliques. La recherche est publiée dans la revue Nature Chemical Biology .
Mydy a identifié le nouveau repliement des protéines végétales et sa nouvelle chimie, qui, selon elle, n'avaient jamais été observées auparavant. La protéine peut générer des peptides cycliques, dont l'un a un potentiel en tant que médicament anticancéreux.
"C'est extrêmement excitant", a déclaré Mydy, chercheur postdoctoral au Département de chimie médicinale. "Ce type de découverte n'arrive pas trop souvent."
Mydy et ses collègues ont étudié la biosynthèse d'une classe de peptides macrocycliques présents dans les plantes et connus pour leur utilisation potentielle comme médicaments thérapeutiques. Ils ont identifié "un nouveau repli protéique fascinant doté d'un mécanisme vraiment inhabituel pour former des peptides cycliques. Il s'agit d'une nouvelle biochimie que nous n'avons jamais vue auparavant", a déclaré Mydy.
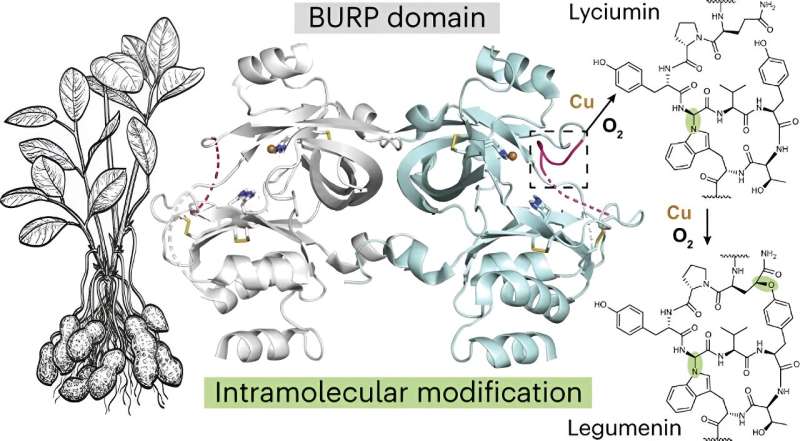
Les chercheurs ont également examiné la peptide cyclase, une protéine appelée AhyBURP trouvée dans les racines de la plante d'arachide, un représentant de la protéine fondatrice Unknown Seed, ou de type USP, qui à son tour fait partie de la famille des protéines du domaine BURP.
"Il n'y avait aucune information expérimentale sur notre protéine AhyBURP", a déclaré Mydy. "Le seul indice que nous avions quant à son fonctionnement était que la protéine avait besoin de cuivre pour cycliser un peptide."
L'équipe de recherche a étudié les structures des protéines par cristallographie aux rayons X et a utilisé la source de photons avancée du laboratoire national d'Argonne. Ce faisant, ils ont découvert que « la protéine AhyBURP utilise le cuivre et l'oxygène d'une manière unique que nous étudions toujours », a déclaré Mydy.
"La plupart des peptides cycliques ont besoin d'une autre enzyme pour effectuer la chimie de cyclisation", a-t-elle déclaré. "Cependant, AhyBURP peut le faire au sein de la même protéine. D'autres protéines dépendantes du cuivre fonctionnent en attachant de l'oxygène quelque part sur le peptide. Nous n'observons pas cela et nous voulons savoir pourquoi. Je vois cela comme le premier exemple de ce type de chimie qui peut se produire avec le cuivre et l'oxygène dans une protéine."
La découverte de la nouvelle protéine est le fruit des travaux en cours dans le laboratoire de Kersten. Dans le cadre de l'UM Natural Product Discovery Initiative, le laboratoire Kersten vise à découvrir et à rechercher de nouveaux produits chimiques à base de plantes qui peuvent devenir des médicaments et, à terme, guérir des maladies humaines.
"Nous utilisons une approche moderne qui consiste à examiner les séquences génétiques des plantes, à la recherche de gènes liés à une nouvelle chimie", a déclaré Kersten, professeur adjoint de chimie médicinale au Collège de pharmacie. "C'est ainsi que nous avons identifié les produits peptidiques cycliques et leurs protéines sous-jacentes comme cibles d'intérêt."
Cette classe de peptides est intéressante car ses propriétés de cyclisation les rendent plus structurés et stables, augmentant ainsi leur potentiel d'utilisation comme médicaments.
De nombreux médicaments, y compris les produits chimiques dérivés d’organismes vivants, sont cycliques, ce qui signifie qu’ils peuvent se lier à des cibles médicamenteuses et rester intacts chez un patient pendant une durée souhaitée. La nature a développé de nombreuses solutions biochimiques pour produire de telles molécules cycliques.
Kersten a isolé d'autres composés fabriqués par la même famille de protéines qui se sont révélés avoir des effets suppresseurs sur les cellules cancéreuses du poumon lors de tests en laboratoire. L'espoir grandit donc que cette découverte ait un potentiel en tant que futur agent anticancéreux.
"Maintenant que nous savons à quoi ressemble la protéine de l'une des protéines du domaine BURP, nous pouvons tester davantage d'idées sur la façon dont la protéine peut influencer la réaction chimique entre le peptide, le cuivre et l'oxygène pour former des peptides cycliques", a déclaré Mydy, un chercheur. biologiste structural et enzymologiste de formation.
"C'est un casse-tête fantastique et stimulant que de comprendre pourquoi cela se produit et d'en comprendre la structure. C'est extrêmement excitant de faire partie de ce type de découverte qui pourrait éventuellement conduire à des thérapies pharmaceutiques efficaces."
Plus d'informations : Lisa S. Mydy et al, Une macrocyclase intramoléculaire dans la biosynthèse des peptides ribosomiques végétaux, Nature Chemical Biology (2024). DOI :10.1038/s41589-024-01552-1
Fourni par l'Université du Michigan