Bien que vous n'ayez peut-être jamais entendu parler de la superfamille d'enzymes du cytochrome P450, ces protéines jouent des rôles divers et essentiels chez l'homme à travers le métabolisme des médicaments, des pesticides, des acides gras, des vitamines liposolubles et des agents chimiques cancérigènes et la biosynthèse des stéroïdes essentiels. y compris les stérols.
Les stérols sont une famille de composés chimiques qui partagent une structure centrale en anneau et qui sont essentiels à la vie d'une multitude d'organismes. Le stérol le plus connu chez l'homme est le cholestérol, un composant clé de notre membrane cellulaire et un élément omniprésent dans l'esprit des médecins, car un taux élevé de cholestérol sanguin peut augmenter notre risque de maladie cardiovasculaire.
Le laboratoire de Fred Guengerich, du Tadashi Inagami, Ph.D. Professeur de biochimie à l'Université Vanderbilt, étudie les cytochromes P450 depuis 50 ans. Dans un nouvel article publié dans Angewandte Chemie , le laboratoire Guengerich a étudié le mécanisme utilisé par le cytochrome P450 51, une enzyme P450 présente dans toutes les familles de la vie, pour catalyser une réaction critique en trois étapes dans la biosynthèse des stérols :le métabolisme du lanostérol.
"Il s'agit d'un projet difficile mais enrichissant qui fournit la première réponse sans ambiguïté à une question mécanistique controversée et de longue date sur la biosynthèse des stérols eucaryotes", a déclaré l'auteur principal et étudiant diplômé en biochimie, Kevin McCarty.
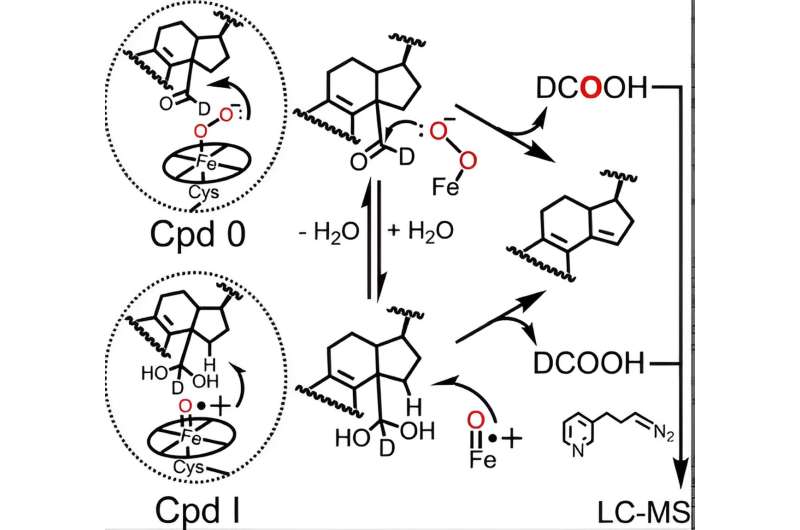
Le cycle catalytique de toutes les enzymes P450 implique la formation de deux espèces actives de fer héminique – le composé 0 et le composé I, ce dernier étant naturellement formé à partir du composé 0 – qui sont nécessaires aux réactions catalysées par le P450, y compris le métabolisme du lanostérol. Bien que le rôle du composé I dans les deux premières étapes du métabolisme du lanostérol ait été bien établi, des données contradictoires provenant de divers laboratoires ont laissé les scientifiques dans le flou quant à savoir si le P450 51 utilise le composé 0 ou le composé I pour accomplir l'étape finale cruciale.
En utilisant une technique analytique avancée initialement affinée par Francis Yoshimoto, ancien postdoctorant de Guengerich, qui suit l'incorporation d'un isotope de l'oxygène appelé 18 . O dans les produits de la réaction P450, McCarty et ses collègues sont devenus les premiers à suggérer que le composé 0 et le composé I peuvent jouer un rôle chimique actif dans la dernière étape du métabolisme du lanostérol.
En effet, les résultats présentés dans le Angewandte Chemie L'article indique que même si le composé 0 est la principale espèce hème responsable de la dernière étape de l'action catalytique du P450 51 humain (~ 85 % de la réaction), le composé I joue toujours un rôle mineur et quantifiable (~ 14 % de la réaction). /P>
En collaboration avec Galina Lepesheva, professeur-chercheur en biochimie, les chercheurs ont comparé les contributions relatives de chaque espèce d'hème dans quatre enzymes P450 51 provenant de levures pathogènes, d'amibes et de trypanosomes, un type de parasite, à l'orthologue humain. Alors que les enzymes de levure et d'amibe ont montré des résultats similaires à ceux des protéines humaines, les résultats des enzymes trypanosomiennes ont révélé une différence mécanistique intéressante :le composé 0 et le composé I partageaient des contributions à peu près égales à la réaction.
Ces résultats approfondissent notre compréhension collective et mécaniste des enzymes P450, en particulier celles impliquées dans la biosynthèse des stérols.
"Il s'agissait d'un long projet qui nécessitait une synthèse chimique en 17 étapes, cinq enzymes P450 51 purifiées différentes de la part de notre collaboratrice, le professeur Galina Lepesheva, une attention très particulière portée à l'utilisation d'une atmosphère à 18 oxygènes dans les réactions, une spectrométrie de masse sophistiquée à haute résolution, et un travail minutieux de la part de tous les auteurs de notre laboratoire", a déclaré Guengerich. Selon lui, l'attention portée aux détails par son équipe lui a permis de « casser ce système » et de fournir une analyse claire d'un mécanisme enzymatique bifurqué.
"Nos résultats constituent une avancée importante dans la compréhension de la fonction du P450 51 chez l'homme et chez divers agents pathogènes, qui, nous l'espérons, seront utiles dans la recherche continue de médicaments ciblant le P450 51", a déclaré McCarty.
Actuellement, un certain nombre de médicaments antifongiques existants inhibent les enzymes fongiques P450 51 afin d'interférer avec la capacité de l'organisme à fabriquer des stérols essentiels et à se reproduire. Pourtant, la résistance aux antifongiques, associée à l'existence d'infections fongiques potentiellement mortelles pour lesquelles il n'existe aucun traitement, souligne le besoin continu de nouveaux médicaments ciblant le P450 51.
Pour l'avenir, les laboratoires Guengerich et Lepesheva analyseront plus en détail une enzyme P450 51 provenant d'une amibe à la recherche de particularités mécanistiques qui pourraient être exploitables comme cibles potentielles de médicaments.
Plus d'informations : Kevin D. McCarty et al, L'étiquetage de l'oxygène-18 révèle un mécanisme mixte Fe−O dans la dernière étape de la déméthylation du cytochrome P450 51 Sterol 14α, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317711
Fourni par l'Université Vanderbilt