Le paclitaxel est le médicament anticancéreux à base de plantes le plus vendu au monde et l'un des médicaments anticancéreux les plus efficaces des 30 dernières années. Il est largement utilisé dans le traitement de divers types de cancer, notamment le cancer du sein, le cancer du poumon et le cancer des ovaires.
À la fin des années 1990 et au début du XXIe siècle, les ventes annuelles de paclitaxel dépassaient 1,5 milliard de dollars et atteignaient 2,0 milliards de dollars en 2001, ce qui en faisait le médicament le plus vendu en 2001. En 2019, le marché du paclitaxel et de ses dérivés s'élevait à environ 15 milliards de dollars, et il devrait atteindre 20 milliards de dollars d'ici 2025.
En tant que médicament anticancéreux, la structure moléculaire du paclitaxel est extrêmement complexe, avec des anneaux pontés complexes et hautement oxydés et 11 stéréocentres, ce qui le rend largement reconnu comme l'un des produits naturels les plus difficiles à synthétiser chimiquement. Depuis que la première synthèse totale du paclitaxel a été rapportée par les groupes de recherche Holton et Nicolaou en 1994, plus de 40 équipes de recherche ont été engagées dans la synthèse totale du paclitaxel.
Cependant, même par la voie de synthèse chimique la plus courte à ce jour, le rendement global du paclitaxel n'est que de 0,118 %, ce qui est loin de répondre à la demande de production industrielle. Actuellement, la production industrielle de paclitaxel utilise une stratégie semi-synthétique :isoler les précurseurs du paclitaxel (tels que la baccatine III) à partir de cultures de cellules végétales ou de feuilles de Taxus, puis les convertir en paclitaxel par des méthodes chimiques. Cependant, la stratégie semi-synthétique repose fortement sur les ressources naturelles et est limitée par la croissance lente des cellules ou des feuilles de Taxus, et ne peut donc pas répondre à la demande croissante du marché.
Avec le développement rapide de la biotechnologie, les stratégies de biologie synthétique pour la biosynthèse microbienne des produits naturels végétaux sont apparues comme une approche puissante pour produire efficacement des produits naturels végétaux complexes.
Par conséquent, parvenir à une production efficace, respectueuse de l’environnement et durable du paclitaxel grâce à la biologie synthétique a attiré une large attention. Cependant, réaliser la synthèse de novo du paclitaxel dans un système hétérologue nécessite d'identifier les enzymes clés manquantes dans la voie de biosynthèse du paclitaxel et d'établir une voie de biosynthèse complète pour le paclitaxel.
Pour relever le défi de longue date de la biosynthèse du paclitaxel dans Taxus, deux équipes de recherche dirigées par le professeur Jianbin Yan (Institut de génomique agricole de Shenzhen, AGIS) et le professeur Xiaoguang Lei (Université de Pékin, PKU), ainsi que d'autres équipes de recherche du cinq autres institutions différentes, dont l'Université Tsinghua et l'UCLA, ont collaboré ensemble pour identifier avec succès les enzymes manquantes et réaliser la reconstitution des enzymes biosynthétiques conduisant à la baccatine III.
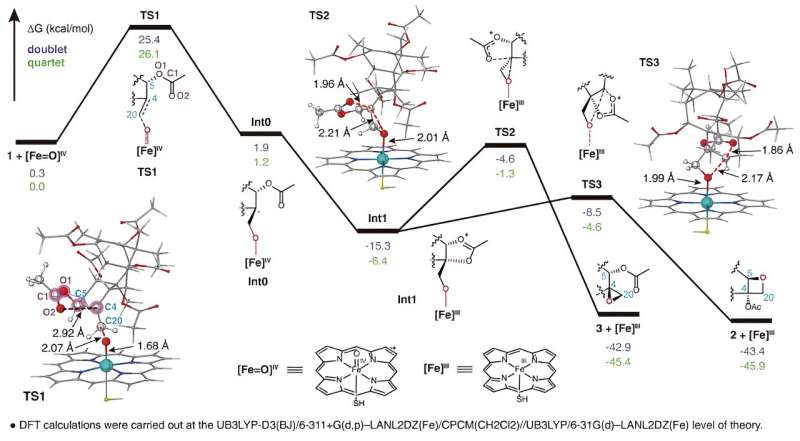
Les chercheurs ont utilisé un système d'expression hétérologue du tabac pour effectuer un dépistage de l'activité de la famille de gènes CYP725A trouvée spécifiquement dans Taxus via une stratégie de co-injection de substrat. Ils ont réussi à identifier une enzyme biosynthétique appelée Taxane oxetanase (TOT) qui catalyse la formation du cycle oxétane au cours de la voie de biosynthèse du taxol.
TOT catalyse la formation du cycle oxétane unique par oxydation de la double liaison C4,20 et réarrangement ultérieur du groupe acétyle adjacent en position C5, comme illustré dans. Ce nouveau mécanisme de réaction de formation du cycle oxétane brise la compréhension conventionnelle selon laquelle le cycle oxétane la formation dans la voie de biosynthèse du taxol est obtenue grâce à une réaction de réarrangement de l'époxyde correspondant.
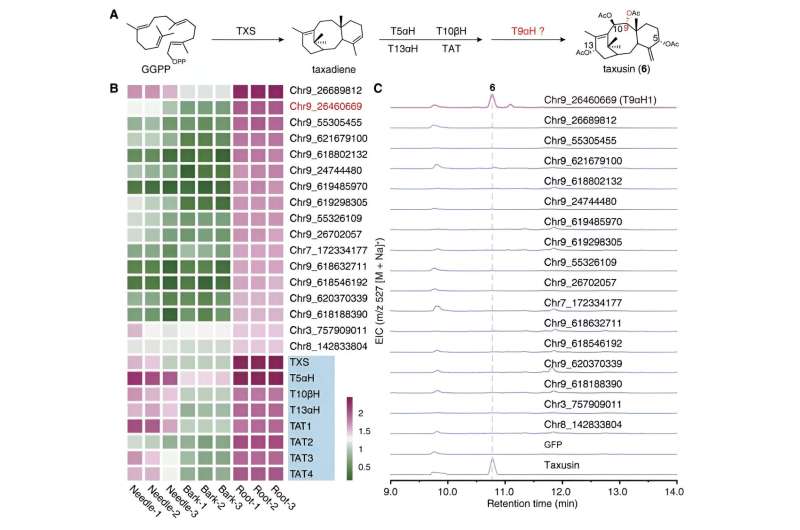
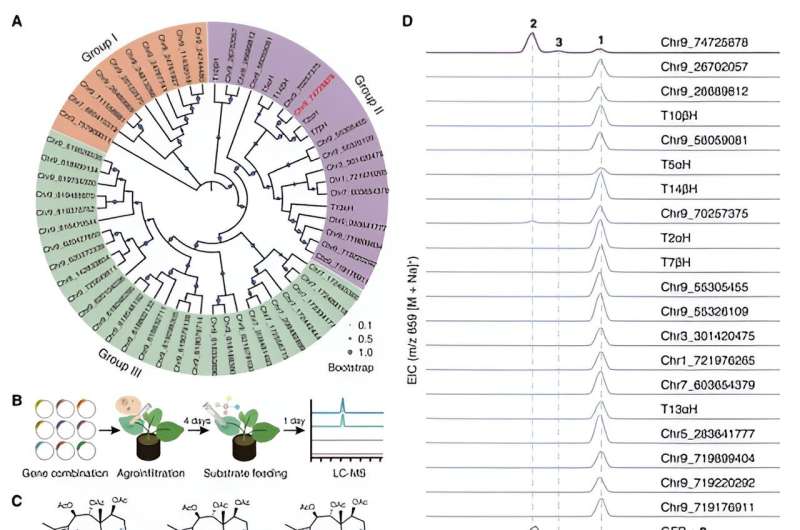
Pendant ce temps, en se concentrant sur le composé structurellement plus simple, la taxusine, les chercheurs ont identifié 17 gènes candidats codant pour des enzymes responsables de l'oxydation C9 des taxanes en utilisant l'analyse de co-expression et l'analyse du métabolisme. Ces gènes candidats ont ensuite été soumis à un criblage d'activité en reconstruisant la voie de biosynthèse de la taxusine dans le tabac, conduisant à la découverte de l'enzyme responsable de l'oxydation du C9 dans les taxanes, appelée Taxane 9α hydroxylase (T9αH).
Avec ces deux enzymes TOT et T9αH nouvellement identifiées, les chercheurs ont tenté de réaliser la biosynthèse totale de la baccatine III dans le tabac en les coexprimant avec d’autres gènes biosynthétiques connus du taxol. Ils ont détecté avec succès la production de baccatine III dans le tabac lorsque TOT et T9αH étaient co-exprimés avec 7 autres gènes biosynthétiques connus (TXS, T5αH, T13αH, T2αH, T7βH, TAT et TBT). De plus, ils ont démontré que ces neuf gènes sont les gènes centraux de la biosynthèse de la baccatine III puisque chaque gène est indispensable à la biosynthèse de la baccatine III dans le tabac.
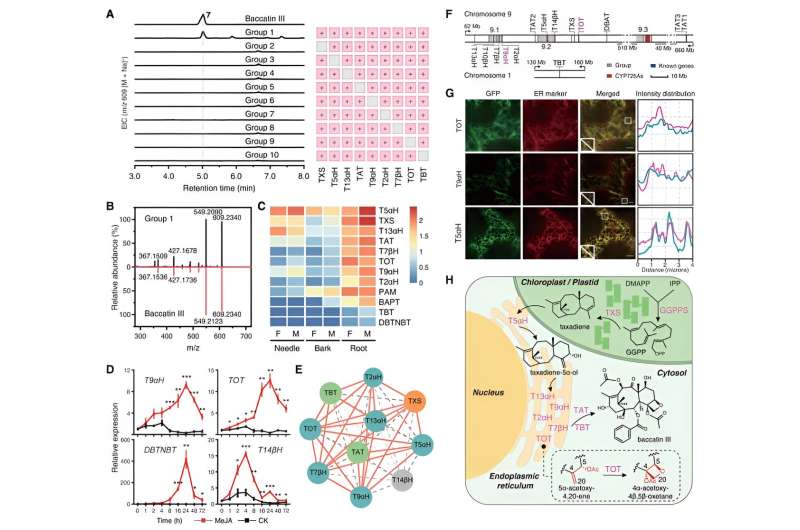
D'autres études biochimiques ont montré que ces gènes centraux présentent une synergie fonctionnelle étroite et sont co-régulés par l'hormone végétale jasmonate, démontrant des modèles d'expression d'induction similaires et une forte corrélation d'expression. En combinant l'analyse de la localisation subcellulaire et d'autres résultats expérimentaux, les chercheurs fournissent un aperçu complet du processus biosynthétique de la baccatine III.
Le substrat de départ GGPP est catalysé par TXS pour former du taxadiène dans les chloroplastes. Par la suite, le taxadiène est transféré dans le cytoplasme via les sites de contact du réticulum plaste-endoplasmique et subit une catalyse concertée par six oxydases liées à la membrane (T2αH, T5αH, T7βH, T9αH, T13αH et TOT) ancrées dans le réticulum endoplasmique et deux acyl cytoplasmiques. transférases (TAT et TBT), aboutissant finalement à la formation de baccatine III.
En résumé, cette étude, publiée dans Science récemment, combine plusieurs analyses omiques et une validation fonctionnelle approfondie pour identifier avec succès les principales enzymes manquantes dans la voie biosynthétique du paclitaxel. Il révèle un nouveau mécanisme par lequel les cellules végétales catalysent la formation d'anneaux oxétane et découvre la voie la plus courte pour la biosynthèse hétérologue du paclitaxel.
En co-exprimant 9 enzymes principales dans le tabac, les chercheurs parviennent à la bioproduction de baccatine III, précurseur du paclitaxel, jetant ainsi les bases d'une production à grande échelle de paclitaxel et fournissant également des conseils théoriques pour les études de biosynthèse sur des centaines d'autres produits naturels à base de taxane.
Plus d'informations : Bin Jiang et al, Caractérisation et reconstitution hétérologue des enzymes biosynthétiques de Taxus conduisant à la baccatine III, Science (2024). DOI :10.1126/science.adj3484
Informations sur le journal : Sciences
Fourni par l'Université de Pékin