
Depuis les années 1950, l’essor de la production mondiale de plastique s’est accompagné d’une augmentation inquiétante des déchets plastiques. Rien qu’aux États-Unis, 35 millions de tonnes de déchets plastiques ont été générées en 2017, dont seule une fraction a été recyclée ou incinérée, laissant la majorité croupir dans les décharges. Le polyéthylène téréphtalate (PET), un contributeur clé aux déchets plastiques, en particulier ceux provenant des emballages alimentaires, pose des défis environnementaux importants en raison de sa lente décomposition et de sa pollution.
Les efforts pour résoudre ce problème se sont intensifiés, les chercheurs explorant des solutions innovantes telles que l’exploitation du pouvoir des micro-organismes et des enzymes pour la dégradation du PET. Cependant, les enzymes existantes ne sont souvent pas efficaces en termes d'efficacité, notamment à des températures propices aux applications industrielles.
Entrez la cutinase, une enzyme prometteuse connue pour sa capacité à décomposer efficacement le PET. Dérivée d'organismes comme Fusarium solani, la cutinase a montré un potentiel remarquable dans la dégradation du PET et d'autres substrats polymères. Les percées récentes incluent la découverte de la cutinase du compost de feuilles et de branches (LCC), présentant des taux de dégradation du PET sans précédent à haute température, et de l'IsPETase, qui excelle à des températures plus basses.
Dans une étude récente publiée dans Catalysis Today , des chercheurs de NYU Tandon dirigés par Jin Kim Montclare, professeur de génie chimique et biomoléculaire, ont présenté un nouveau flux de travail de criblage informatique utilisant des protocoles avancés pour concevoir des variantes de LCC avec des capacités de dégradation améliorées du PET similaires à celles de l'isPETase.
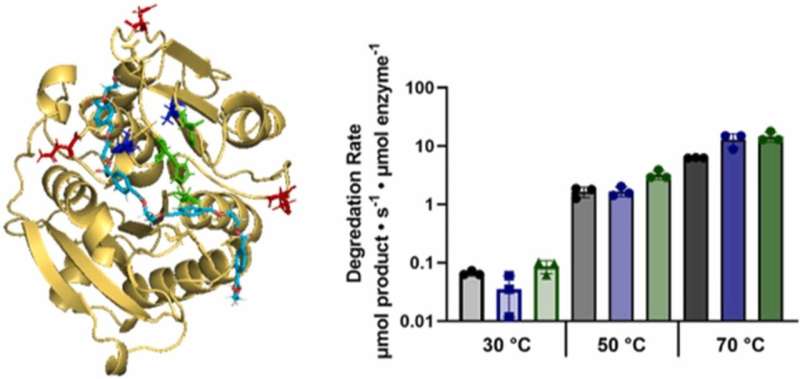
En intégrant la modélisation informatique aux tests biochimiques, ils ont identifié des variantes prometteuses présentant un comportement d'hydrolyse accru, même à des températures modérées.
Cette étude souligne le potentiel transformateur du criblage informatique dans la refonte des enzymes, offrant de nouvelles voies pour lutter contre la pollution plastique. En intégrant les connaissances d'enzymes naturelles telles que l'IsPETase, les chercheurs ouvrent la voie au développement d'enzymes hydrolysant le PET très efficaces, avec des implications significatives pour la durabilité environnementale.
Plus d'informations : Dustin Britton et al, Variantes de cutinase de compost de feuilles et de branches conçues par ingénierie protéique à l'aide du criblage informatique et de l'homologie IsPETase, Catalysis Today (2024). DOI :10.1016/j.cattod.2024.114659
Fourni par la NYU Tandon School of Engineering