Les biochimistes travaillent depuis longtemps sur un angle mort en ce qui concerne les protéines. Ils savent que l’hydrogène constitue près de la moitié des atomes des protéines, mais la manière dont ils contribuent au fonctionnement des protéines dans ces structures complexes est moins claire. Les atomes d'hydrogène sont si petits que les techniques traditionnelles de biologie structurale ne peuvent pas révéler leur position.
"Il vous manque donc la moitié de l'information", a déclaré le Dr Victoria Drago, associée de recherche postdoctorale au Laboratoire national d'Oak Ridge (ORNL) dans le Tennessee et récente ancienne élève de l'Université de Toledo.
Ne pas avoir une comptabilité complète de l'emplacement des atomes d'hydrogène d'une protéine est une énigme avec des implications au-delà du laboratoire, y compris dans la conception de médicaments basés sur la structure.
Drago a commencé à explorer une technique pour identifier des hydrogènes autrement insaisissables qui impliquait la croissance de cristaux de protéines en microgravité alors qu'il était étudiant diplômé aux côtés du Dr Timothy Mueser, professeur au département de chimie et de biochimie de l'UToledo.
L'analyse de ces cristaux - un terme chimique qui fait référence dans ce cas à la disposition précise des atomes et des molécules constitutifs - est à la base d'un article de recherche récemment publié dans la revue Cell Reports Physical Science. .
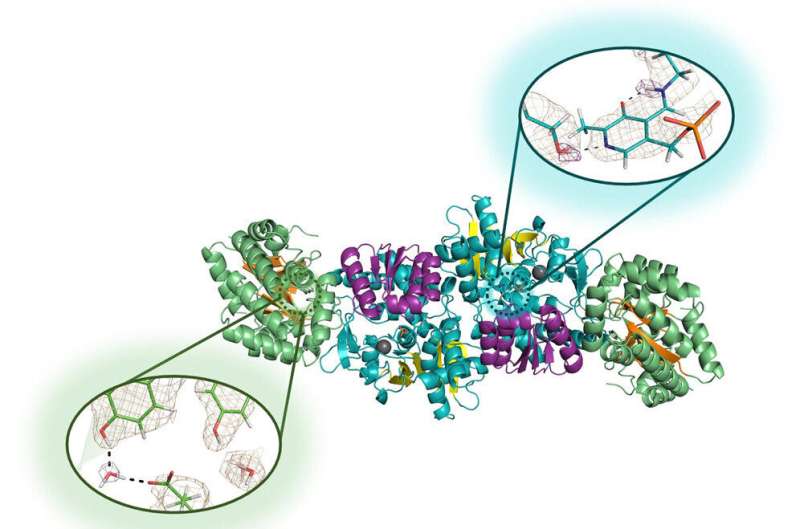
"Nous avons utilisé la diffraction des neutrons", a déclaré Drago, auteur principal de l'article et diplômé d'un doctorat en chimie en 2022. "Nous avons pu réaliser l'expérience et atteindre une haute résolution en tirant parti de la microgravité pour cultiver des cristaux de haute qualité. de l'enzyme."
La diffraction des neutrons est un processus de haute technologie qui permet aux chercheurs de cartographier les emplacements précis de chaque atome d'une molécule. Il permet d'identifier l'emplacement de minuscules atomes d'hydrogène, comme pour d'autres atomes, mais le signal est extrêmement faible dans les techniques traditionnelles de biologie structurale. C'est pourquoi ils se sont tournés vers la microgravité, qui permet la croissance de cristaux plus gros et mieux structurés.

Drago, Mueser et leurs collaborateurs de l'ORNL et de l'Institut Laue-Langevin, un centre de recherche nucléaire de premier plan à Grenoble, en France, ont envoyé des solutions de l'enzyme tryptophane synthase pour une tournée d'un mois sur la Station spatiale internationale en 2018, et de nouveau pour une tournée d'un mois. voyage de six mois entre 2019 et 2020. Le deuxième voyage a produit plusieurs très gros cristaux parfaits – dont beaucoup environ un millimètre cube, cinq fois plus gros que ceux que les chercheurs ont cultivés en laboratoire – qui ont parcouru plus de 50 millions de kilomètres et ont survécu à un amerrissage de 9G dans le Océan Pacifique.
La diffraction neutronique s'est avérée efficace sur ces cristaux, permettant aux chercheurs de révéler pour la première fois les hydrogènes du site actif de l'enzyme qu'ils ont choisi d'étudier.
La tryptophane synthase est scientifiquement précieuse en tant que représentant d’une grande famille d’enzymes très polyvalente qui utilise la vitamine B6 pour son fonctionnement. Parce que les êtres humains ne produisent pas de tryptophane synthase, cela est également intéressant pour les concepteurs de médicaments intéressés à exploiter la structure chimique des protéines dans leur développement de nouveaux composés pour lutter contre les micro-organismes pathogènes tels que Salmonella enterica, Staphylococcus aureus et Mycobacterium tuberculosis.
Plus d'informations : Victoria N. Drago et al, La diffraction des neutrons à partir d'un cristal cultivé en microgravité révèle les hydrogènes du site actif de la forme aldimine interne de la tryptophane synthase, Cell Reports Physical Science (2024). DOI :10.1016/j.xcrp.2024.101827
Informations sur le journal : Rapports cellulaires sur la science physique
Fourni par l'Université de Tolède