Le premier et le plus connu des métallocènes est le « ferrocène », qui contient un seul atome de fer. Aujourd'hui, les complexes sandwich peuvent être trouvés dans de nombreux manuels de chimie inorganique, et la liaison et la structure électronique des métallocènes sont enseignées dans les cours de chimie de premier cycle. Les molécules sandwich jouent également un rôle important dans l'industrie, où elles sont utilisées comme catalyseurs et dans la synthèse de métallopolymères spéciaux.
Personne ne sait exactement combien de molécules sandwich il existe aujourd’hui, mais leur nombre se compte certainement en milliers. Et ils ont tous une chose en commun :un seul atome métallique situé entre deux anneaux plats d'atomes de carbone.
C'est du moins ce que l'on pensait jusqu'en 2004, lorsqu'un groupe de recherche de l'Université de Séville a fait une découverte surprenante. L'équipe de recherche espagnole a réussi à synthétiser une molécule sandwich contenant non pas un mais deux atomes métalliques. Pendant longtemps, ce "dimétallocène" contenant deux atomes de zinc est resté le seul exemple de ce type jusqu'à ce qu'un groupe britannique réussisse l'année dernière à synthétiser une molécule très similaire contenant deux atomes de béryllium.
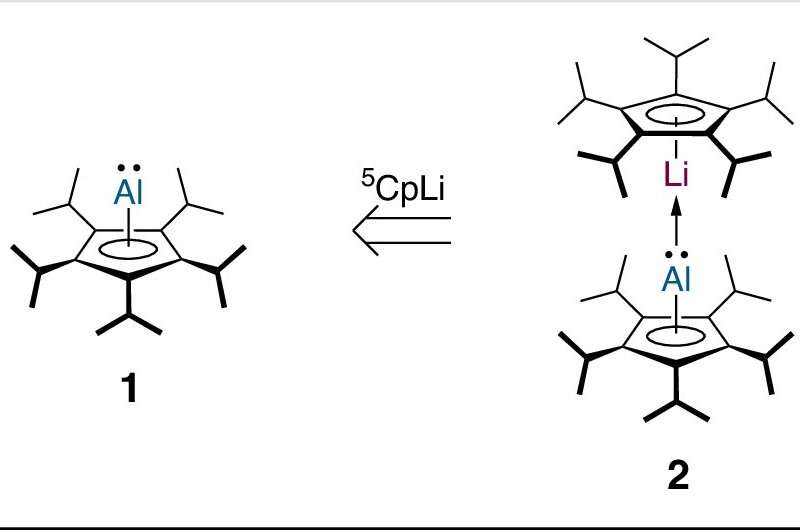
Aujourd'hui, Inga Bischoff, doctorante dans l'équipe de recherche du Dr André Schäfer à l'Université de la Sarre, va encore plus loin. Elle a réussi à synthétiser en laboratoire le premier complexe sandwich « hétérobimétallique » au monde :un dimétallocène qui contient deux atomes métalliques différents.
Peu de temps après la découverte du premier dimétallocène en 2004, des travaux théoriques ont montré que les dimétallocènes ne doivent pas nécessairement contenir deux atomes métalliques identiques et qu'un complexe comprenant deux atomes métalliques différents doit également être stable. Ces prédictions ont été faites sur la base de calculs de modélisation chimique quantique utilisant des ordinateurs puissants. Malgré cette stabilité prévue, toutes les tentatives pour créer une telle molécule en laboratoire ont échoué jusqu'à la percée actuelle de Bischoff.
"C'est vraiment excitant et spécial quand vous réalisez ce que vous tenez dans vos mains. À l'œil nu, cela ressemble à une autre poudre blanche. Mais je me souviens encore clairement du moment où nous avons vu pour la première fois la structure moléculaire déterminée expérimentalement sur l'écran de l'ordinateur et nous savions que nous avions une molécule sandwich avec deux atomes métalliques différents", a déclaré le Dr Schäfer.

"Les anneaux de carbone que vous choisissez sont tout aussi importants que les atomes métalliques que vous souhaitez enfermer entre eux. Ceci est essentiel car les structures électroniques des anneaux de carbone cycliques et des atomes métalliques doivent correspondre", a expliqué Bischoff.
"Les métaux contenus dans notre "dimétallocène hétérobimétallique" sont le lithium et l'aluminium. Les calculs ont prédit que ces deux métaux seraient des candidats appropriés car leur structure électronique est dans un certain sens similaire à celle de deux atomes de zinc, dont nous savions qu'ils pourraient former un dimétallocène stable. "
Mais ce qui semble si simple et direct a pris des mois à réaliser. La molécule s’avère si réactive qu’elle ne peut être synthétisée, stockée et analysée que sous une couverture inerte d’azote ou d’argon. S'il entrait en contact avec l'air, il se décomposerait simplement.
Une fois synthétisée, il a fallu caractériser la molécule, ce qui a impliqué toute une équipe de scientifiques de l'Université de la Sarre. Les résultats de leurs travaux ont été publiés dans Nature Chemistry .
"Notre dimétallocène hétérobimétallique représente en fait une toute nouvelle classe de molécules sandwich", a déclaré le Dr Schäfer, responsable du groupe. "Qui sait, peut-être qu'un jour cela sera également inclus dans un manuel scolaire. Mais avant tout, nous devons l'étudier plus en profondeur.
"Pour le moment, nous avons une assez bonne compréhension de sa structure, mais nous en savons encore très peu sur sa réactivité. Si nous trouvons d'autres combinaisons appropriées d'atomes métalliques, il pourrait bien s'avérer possible à l'avenir de synthétiser d'autres dimétallocènes hétérobimétalliques."
Plus d'informations : Inga-Alexandra Bischoff et al, Un dimétallocène hétérobimétallique lithium-aluminium, Nature Chemistry (2024). DOI :10.1038/s41557-024-01531-y
Informations sur le journal : Chimie naturelle
Fourni par l'Université de la Sarre