Les organismes multicellulaires, comme les animaux et les plantes, possèdent des cellules complexes aux fonctions diverses. Cette complexité résulte de la nécessité pour les cellules de produire des protéines distinctes qui interagissent les unes avec les autres. Cette interaction est cruciale pour que les cellules puissent accomplir leurs tâches spécifiques et former une machinerie moléculaire complexe.
Cependant, notre compréhension actuelle de ces interactions protéine-protéine manque souvent de contextes cellulaires, car elles ont généralement été étudiées dans un système in vitro ou dans des cellules isolées de leur environnement tissulaire. Il manque en grande partie des méthodes efficaces pour étudier les interactions protéine-protéine de manière spécifique aux tissus.
Pour combler ce fossé technologique, une équipe de recherche collaborative de l'Université de Hong Kong (HKU), dirigée par le professeur Xiang David Li du Département de chimie et le professeur Chaogu Zheng de l'École des sciences biologiques, tous deux de la Faculté des sciences, avec le Dr Xiucong Bao de l'École des sciences biomédicales de la Faculté de médecine Li Ka Shing, a récemment développé une nouvelle approche de biologie chimique.
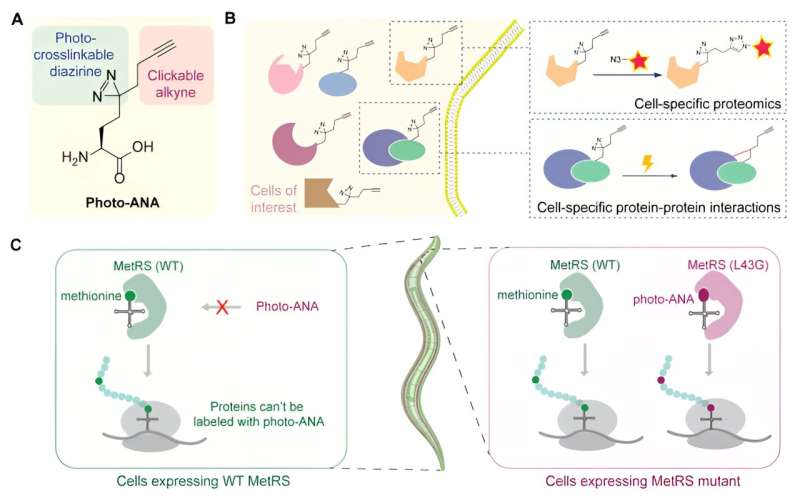
L'équipe a marqué des protéines provenant de cellules spécifiques avec une sonde d'acides aminés bifonctionnelle qui permet d'isoler les protéines marquées et de capturer les interactions protéine-protéine par photo-réticulation.
Cette nouvelle méthode, MEthionine Analog-based Cell-Specific Proteomics and Interactomics (MACSPI), a permis à l'équipe d'identifier de nombreuses nouvelles protéines et interactions protéiques spécifiques aux tissus, nous aidant ainsi à mieux comprendre le fonctionnement des cellules dans les organismes vivants et à étudier divers problèmes biologiques, tels que le développement des organes et la pathogenèse des maladies.
Le travail a été récemment publié dans les Proceedings of the National Academy of Sciences. .
L'équipe a conçu et synthétisé un acide aminé non naturel (photo-ANA) dont la structure est similaire à la méthionine, l'acide aminé naturel, mais avec deux composants supplémentaires.
Un composant est un groupe alcyne, qui peut être utilisé comme poignée chimique pour les protéines marquées à extraire et purifier. L'autre est un groupe diazirine, qui peut être activé par la lumière pour créer des liaisons covalentes stables entre les protéines marquées et toutes les molécules avec lesquelles elles interagissent.
Ensuite, l’équipe a conçu une enzyme appelée MetRS pour créer une variante capable de reconnaître et d’incorporer l’acide aminé non naturel dans les protéines au fur et à mesure de leur construction. En contrôlant l'expression de cette enzyme modifiée dans des tissus spécifiques, seules les protéines du tissu d'intérêt sont marquées par une sonde chimique. De plus, grâce à la réticulation induite par la lumière, des complexes protéiques provenant de tissus spécifiques peuvent être capturés et isolés.
En guise de preuve de concept, l'équipe a appliqué la méthode MACSPI pour profiler les protéines des cellules musculaires et des neurones, respectivement, dans un organisme modèle appelé C. elegans et a découvert de nombreuses nouvelles protéines spécifiques aux tissus.
L'équipe a également démontré l'utilité de la méthode pour capturer l'interaction protéine-protéine spécifique d'un tissu en identifiant les interactions spécifiques d'un tissu d'une protéine exprimée de manière omniprésente, telle que le chaperon moléculaire appelé HSP90. Il a été découvert que HSP90 se lie à des ensembles distincts de protéines pour réguler différents processus biologiques dans les muscles et les neurones.
"Cette étude est un excellent exemple de la façon dont les méthodes innovantes de marquage chimique peuvent aider à résoudre des problèmes biologiques difficiles", a déclaré le professeur Xiang David Li.
"Comprendre l'interaction protéine-protéine à la résolution cellulaire est souvent essentiel pour déchiffrer le mécanisme moléculaire d'un processus pathologique. Par exemple, nous explorons actuellement les fonctions des interactions neuronales HSP90 que nous avons identifiées ; certains semblent être impliqués dans la neurodégénérescence dans la maladie de Parkinson. modèle de maladie", a déclaré le professeur Chaogu Zheng.
L'équipe envisage que la méthode MACSPI puisse être utilisée dans de nombreux organismes multicellulaires pour profiler les protéomes et les Interactives avec une spécificité spatiale et temporelle, ce qui peut faciliter un large spectre de recherche biologique et biomédicale.
Plus d'informations : Siyue Huang et al, MACSPI permet des analyses protéomiques et interactives sélectives des tissus dans les organismes multicellulaires, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2319060121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'Université de Hong Kong