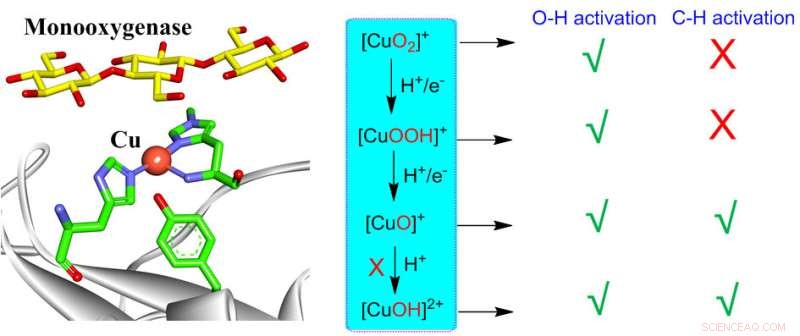
L'activation du dioxygène par le cuivre mononucléaire dans les systèmes biologiques et synthétiques peut générer divers intermédiaires cuivre-oxygène, notamment [CuO2 ] + , [CuOOH] + , [CuO] + , [CuOH] 2+ . Toutes ces espèces sont capables d'effectuer une activation O-H, alors que seulement [CuO] + et [CuOH] 2+ sont réactifs pour l'activation C-H. Cependant, la formation de [CuOH] 2+ est très défavorable aux monooxygénases, laissant [CuO] + comme le seul intermédiaire actif responsable de l'activation C-H dans les monooxygénases. Ces connaissances peuvent fournir une compréhension cohérente des réactivités de diverses espèces actives cuivre-oxygène dans les systèmes biologiques et synthétiques. Crédit :Chinese Journal of Catalysis
Les activations du dioxygène constituent l'un des problèmes centraux des métalloenzymes dépendantes du cuivre. Sur O2 activation, les métalloenzymes dépendantes du cuivre, y compris les méthane monooxygénases particulaires (pMMO), les polysaccharides monooxygénases lytiques (LPMO) et les enzymes binucléaires du cuivre PHM et DBM, sont capables d'effectuer des activations difficiles de la liaison C-H/O-H.
Pendant ce temps, des complexes contenant un noyau cuivre-oxygène ont été synthétisés pour imiter les espèces actives des métalloenzymes. L'activation du dioxygène par le site actif du cuivre mononucléaire peut générer des intermédiaires cuivre-oxygène, notamment Cu(II)-superoxo, Cu(II)-hydroperoxo, Cu(II)-oxyle ainsi que les espèces Cu(III)-hydroxyde.
Curieusement, toutes ces espèces ont été invoquées comme intermédiaires actifs potentiels pour les activations C-H/O-H dans des systèmes biologiques ou synthétiques. En raison de la mauvaise compréhension des réactivités du complexe cuivre-oxygène, la nature des espèces actives dans les systèmes biologiques et synthétiques est très controversée.
Récemment, une équipe de recherche dirigée par le professeur Binju Wang de l'Université de Xiamen, en Chine, a mesuré les réactivités de diverses espèces mononucléaires de cuivre-oxygène dans les systèmes biologiques et les systèmes synthétiques. L'étude montre :
Ces connaissances devraient fournir une compréhension cohérente des réactivités de diverses espèces actives cuivre-oxygène dans les systèmes biologiques et synthétiques.
La revue a été publiée dans le Chinese Journal of Catalysis . Des scientifiques révèlent le mécanisme d'activation du dioxygène