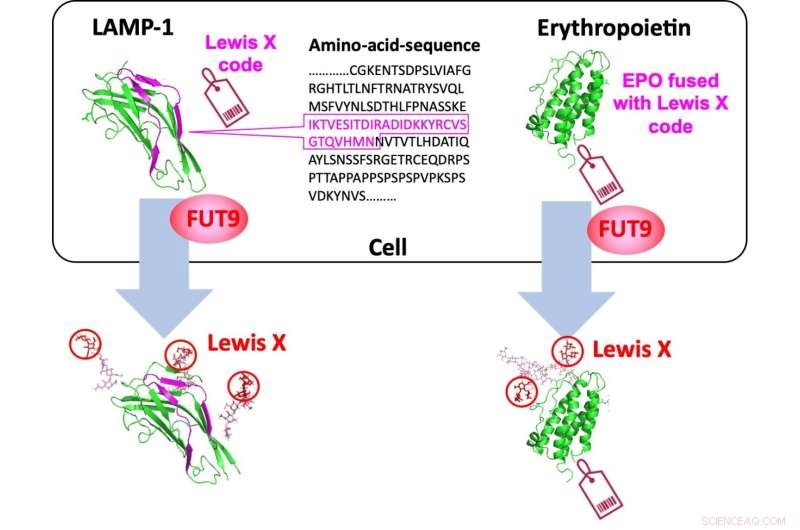
La séquence spécifique de 29 acides aminés de LAMP-1 sert de "code Lewis X", qui est déchiffré par FUT9, et il peut être intégré dans l'érythropoïétine pour évoquer la modification Lewis X. Crédit :École supérieure des sciences pharmaceutiques de l'Université de la ville de Nagoya
De nombreuses protéines dans la nature existent sous forme de glycoprotéines, constituées de protéines (chaîne polypeptidique) et de glycane (chaîne de sucre). La structure de la protéine est déterminée sur la base de son empreinte génétique, mais les informations sur les glycanes ne sont pas directement codées par le génome. Par conséquent, il est difficile de contrôler la glycosylation des protéines.
Dans ces circonstances, un groupe de recherche collaboratif, comprenant des chercheurs de la Nagoya City University, des National Institutes of Natural Sciences et de l'Academia Sinica, a découvert une séquence d'acides aminés spécifique dans un polypeptide qui induit une structure glycane spécifique appelée Lewis X. Les chercheurs au Japon ont précédemment montré que Lewis X modifie spécifiquement la protéine LAMP-1 dans les cellules souches neurales de souris par l'action enzymatique de la fucosyltransférase 9 (FUT9).
Dans cette étude la plus récente publiée dans Communications Biology , ils ont montré que la modification de Lewis X spécifique de LAMP-1 se produit non seulement dans les cellules souches neurales mais également dans plusieurs cellules de mammifères en culture. De plus, ils ont découvert qu'une séquence constituée de 29 résidus d'acides aminés dans LAMP-1 favorise la modification de Lewis X catalysée par l'enzyme, et cette séquence induit la modification de Lewis X lorsqu'elle est fusionnée à d'autres protéines utilisées comme biopharmaceutiques. Cela signifie que dans les molécules de glycoprotéines, une séquence spécifique d'acides aminés peut déterminer leurs structures de glycane.
La plupart des produits biopharmaceutiques sont des glycoprotéines, mieux illustrées par les anticorps thérapeutiques. Leurs structures glycanes sont essentielles pour leur efficacité et leur innocuité. Par conséquent, le contrôle de la glycosylation est un enjeu important dans le développement des biopharmaceutiques. Ces découvertes sur un code réglementaire de la glycosylation des protéines devraient ouvrir la voie au contrôle de la glycosylation des produits biopharmaceutiques. Une combinaison gagnante pour la synthèse des glycoprotéines