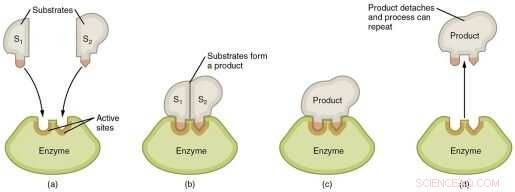
Représentation graphique des étapes d'une réaction enzymatique. Crédit :Wikimedia Commons
Les enzymes présentes dans les organismes vivants ont un pouvoir catalytique impressionnant. Grâce aux enzymes, les réactions chimiques qui maintiennent la vie se produisent des millions de fois plus rapidement qu'elles ne se produiraient sans elles. Les enzymes accélèrent les réactions en aidant à réduire l'énergie d'activation nécessaire pour les démarrer, mais depuis plus de 70 ans, la manière dont les enzymes y parviennent fait l'objet d'intenses débats.
Le Dr Tor Savidge, professeur de pathologie et d'immunologie au Baylor College of Medicine et au Texas Children's Microbiome Center, et ses collègues changent la façon de voir ce vieil argument. Dans leurs travaux publiés dans Chemical Science , ils ont étudié les similitudes et les différences entre les deux mécanismes actuellement débattus en caractérisant les réactions catalytiques à un niveau moléculaire détaillé.
"À l'heure actuelle, deux grands mécanismes de réaction différents sont proposés pour expliquer le pouvoir catalytique enzymatique", a déclaré Savidge. "L'une propose que les enzymes réduisent l'énergie d'activation de la réaction via la stabilisation des états de transition (TS) et l'autre qu'elles le fassent en déstabilisant l'état fondamental (GS) des enzymes. L'idée actuelle est que ces mécanismes s'excluent mutuellement."
Le premier auteur, le Dr Deliang Chen de l'Université normale de Gannan en Chine, et ses collègues ont adopté une approche théorique, en tenant compte des découvertes antérieures du laboratoire Savidge montrant que les interactions non covalentes des substrats et des enzymes avec l'eau sont importantes en termes de mécanisme de l'enzymatique. réactions.
"Dans un environnement biologique, vous devez considérer l'eau - qu'elle va interférer avec les interactions atomiques très complexes se produisant dans le site actif de l'enzyme. Nous devons tous les considérer pour comprendre où exactement vous devez avoir des interactions électrostatiques qui sont va favoriser ce processus enzymatique », a déclaré Savidge. "Lorsque vous prenez cela en considération, vous pouvez comprendre comment ces mécanismes fonctionnent."
Leurs analyses ont conduit l'équipe à proposer quelque chose de nouveau :que TS et GS ne sont finalement pas si différents. Ils utilisent un mécanisme atomique similaire pour stimuler la réaction enzymatique vers l'avant. Le mécanisme implique que l'eau modifie la charge des résidus importants dans le site catalytique d'une manière qui favorise la formation d'un état énergétiquement favorable qui conduit la réaction enzymatique à se produire.
"Le nouveau point important ici n'est pas comment cela est réalisé mais quand cela est réalisé", a déclaré Savidge. "Nous avons montré que dans la stabilisation des états de transition, les charges qui font avancer la réaction sont formées avant que le substrat n'entre dans le site actif. Dans l'état fondamental de déstabilisation, cela se produit également, mais après que le substrat entre dans le site actif."
Les chercheurs ont également proposé que le mécanisme commun entre TS et GS est universel; il peut être appliqué à de nombreuses réactions enzymatiques.
Leurs découvertes ont des implications importantes non seulement pour aider les chercheurs à mieux comprendre le pouvoir catalytique des enzymes, mais aussi pour les applications pratiques de conception de médicaments.
"Nous utilisons nos découvertes pour explorer plus en profondeur la catalyse enzymatique microbienne dans différents environnements et pour concevoir des enzymes artificielles", a déclaré Savidge.
Yibao Li, Xun Li, Xiaolin Fan, de l'Université normale de Gannan, et Xuechuan Hong de l'École des sciences pharmaceutiques de l'Université de Wuhan ont également contribué à ce travail. Cartographier les champs électriques pour aider à comprendre le fonctionnement des enzymes