Crédit :Université de Kumamoto
Les protéines qui composent nos cellules contiennent tout un monde d'informations qui, une fois déverrouillées, peuvent nous donner un aperçu des origines de nombreux phénomènes biologiques essentiels. Ces informations sont recueillies à l'aide d'une technique analytique connue sous le nom de "protéomique unicellulaire", dans laquelle une analyse unicellulaire est effectuée pour observer les caractéristiques des cellules individuelles à leur niveau protéique. Au fil des ans, les scientifiques ont utilisé la protéomique unicellulaire dans les domaines de la génomique du cancer, de la différenciation cellulaire et du développement tissulaire. Cependant, les techniques protéomiques actuelles souffrent d'un faible taux de récupération des échantillons de protéines, d'un faible débit et d'un manque de polyvalence.
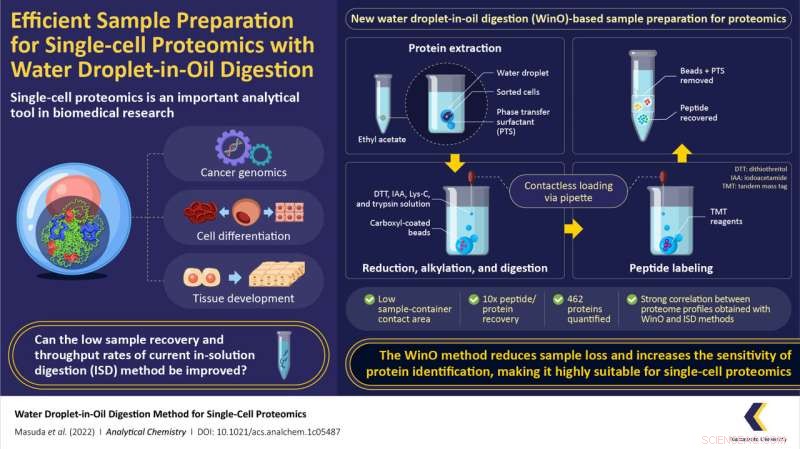
Heureusement, une équipe de chercheurs du Japon et des États-Unis dirigée par le professeur adjoint Takeshi Masuda de l'Université de Kumamoto au Japon a trouvé une solution à ces problèmes. Dans une étude récente mise en ligne le 11 juillet 2022 et publiée dans Analytical Chemistry le 26 juillet 2022, l'équipe a introduit une méthode simple mais très efficace de préparation d'échantillons pour la protéomique unicellulaire appelée "méthode goutte d'eau dans l'huile" (WinO). La technique utilise l'immiscibilité de l'eau avec l'huile/solvant organique à son avantage pour préparer des échantillons de protéines avec une perte minimale et des chances accrues de récupération de l'échantillon.
"Pour rendre la protéomique unicellulaire plus efficace, nous devons soit amplifier l'échantillon de protéines, soit nous assurer qu'aucune partie n'est perdue lors de la préparation de l'échantillon. Comme nous n'avions pas les moyens de faire la première, il était crucial que nous réduisions l'absorption pertes lors des étapes de préparation des échantillons comme le transfert d'échantillons », explique le Dr Masuda. "La technique WinO réduit non seulement la perte d'échantillons par adsorption, mais offre également un meilleur débit par rapport aux méthodes conventionnelles."
Pour le processus WinO, l'équipe a d'abord préparé un tampon d'extraction en mélangeant un microlitre d'eau avec des tensioactifs à transfert de phase (qui augmentent la solubilité des protéines hydrophobes) et des billes nanomagnétiques hydrophobes revêtues de carboxyle. Ce mélange a ensuite été versé dans 50 microlitres d'acétate d'éthyle.
L'étape suivante était l'extraction des protéines, qui a été réalisée en ajoutant des gouttelettes de cellules du trieur de cellules au combo acétate d'éthyle-gouttelettes d'eau et en le faisant tourner dans une centrifugeuse pour permettre à la protéine de s'accumuler dans la gouttelette d'eau. Après l'extraction, l'échantillon a été digéré à l'aide d'une enzyme protéique, Lys-C, et marqué à l'aide d'un réactif "tandem mass tag". L'échantillon extrait-digéré-marqué a ensuite été purifié et récupéré pour une analyse unicellulaire et des profils protéomiques.
Pour comparer l'efficacité de la méthode WinO par rapport aux méthodes conventionnelles, l'équipe a également préparé des échantillons à l'aide de la méthode standard de digestion en solution (ISD) et effectué une analyse protéomique. Ils ont découvert que la méthode WinO entraînait une multiplication par 10 de la récupération des protéines et des peptides par rapport à l'ISD. Cette amélioration remarquable a été attribuée à une zone de contact réduite entre la solution d'extraction et le conteneur d'échantillon.
Pour analyser la sensibilité des deux méthodes, l'équipe a également comparé les profils protéomiques obtenus. Ils ont observé une forte corrélation entre les profils protéomiques obtenus pour 100 cellules avec WinO et celui pour 10 000 cellules avec ISD. De plus, l'équipe a réussi à quantifier 462 protéines à l'aide de WinO, démontrant qu'il offrait un débit et une efficacité d'extraction beaucoup plus élevés que les techniques conventionnelles.
La capacité améliorée de récupération et d'identification des protéines fournie par WinO pourrait permettre d'examiner de plus près l'expression des protéines des cellules cancéreuses et de mieux comprendre les mécanismes sous-jacents à la résistance aux médicaments anticancéreux. De plus, WinO peut être semi-automatisé à l'aide d'un robot de manipulation de liquide, ce qui le rend adapté au traitement à grande vitesse et à grande capacité des échantillons. « Notre recherche pourrait permettre aux scientifiques d'effectuer de la protéomique sur des quantités d'échantillons rares et limitées ainsi que de fournir une nouvelle perspective sur l'expression des protéines, ouvrant des possibilités pour découvrir de nouveaux phénomènes biologiques », conclut le Dr Masuda. Analyse rapide et facile des protéines à partir de traces d'échantillons cellulaires