
Figure 1. Une nouvelle technique d'observation des membranes cellulaires vivantes pour l'AFM à l'aide d'une membrane poreuse en nitrure de silicium (MPM). (a) L'apparition de MPM. (b) Les trous de MPM observés par AFM. (c) Le MPM lorsqu'il est placé dans la chambre pour observation. ( d ) Schéma de l'observation de la surface cellulaire AFM à l'aide de MPM. Crédit :Université de Kanazawa
Des chercheurs de l'Université de Kanazawa rapportent en biologie des communications que l'utilisation de produits chimiques courants pour fixer des échantillons de cellules vivantes pour des études de microscopie provoque l'agrégation des protéines membranaires.
Pour les investigations histologiques des tissus biologiques, c'est-à-dire les études anatomiques au microscope, les échantillons sont généralement fixés pour les empêcher de se décomposer. La fixation est généralement effectuée en immergeant ou en perfusant l'échantillon dans un produit chimique - les aldéhydes et les alcools sont des fixateurs courants. Il a été spéculé que les protéines membranaires se déplaçant dans une certaine mesure sur une membrane cellulaire peuvent former des agrégats pendant la fixation. Pourtant, des études détaillées de la surface cellulaire avec une résolution à l'échelle nanométrique sont nécessaires pour obtenir des informations définitives sur ce problème potentiel. Maintenant, Takehiko Ichikawa et ses collègues de l'Université de Kanazawa ont effectué des études de microscopie à force atomique (AFM) sur des surfaces de cellules de mammifères vivants. En comparant des échantillons non fixés et fixés, ils ont constaté que la fixation entraîne effectivement des changements structurels.
Les chercheurs ont développé une méthode d'utilisation d'une membrane microporeuse en nitrure de silicium (MPM), utilisée en microscopie électronique à transmission (Figure 1), pour l'imagerie AFM. Surtout, MPM peut rendre la surface de la cellule plate et empêcher les fluctuations en soutenant la zone en dehors de la zone d'observation. Dans les images AFM des surfaces des cellules cancéreuses du côlon cultivées sur MPM, les structures biomoléculaires sur les membranes cellulaires se sont révélées sous forme de protubérances d'une taille typique de quelques nanomètres (Figure 2 surface cellulaire vivante).
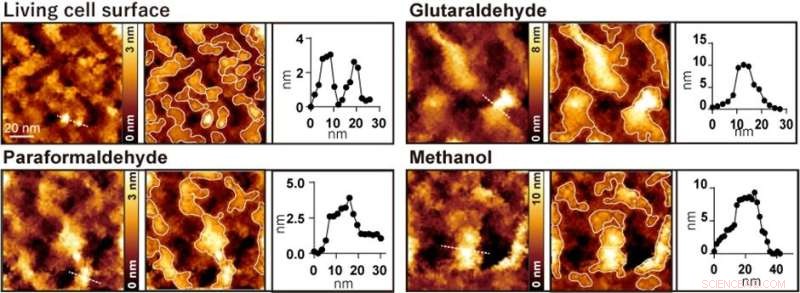
Figure 2. Observation de la surface cellulaire AFM avant et après traitement avec du glutaraldéhyde, du paraformaldéhyde et du méthanol, respectivement. L'image de gauche est une image AFM, l'image centrale est une image AFM avec les saillies encadrées et l'image de droite est un profil de hauteur le long de la ligne pointillée dans l'image de gauche. Crédit :Université de Kanazawa
Lorsque les cellules ont été traitées avec des fixateurs couramment utilisés tels que le paraformaldéhyde, le glutaraldéhyde et le méthanol, quelques structures nanométriques ont disparu et seules de grandes saillies de diamètres allant de 20 à 100 nanomètres ont été observées (Figure 2). Les chercheurs ont réalisé plusieurs expériences de fluorescence et ont conclu que les grandes saillies observées après fixation étaient formées par l'agrégation de protéines membranaires.
L'étude démontre que les agrégats observés sont des artefacts résultant du processus de fixation. Cela devrait appeler à la prudence parmi la communauté des chercheurs travaillant avec des fixateurs chimiques. Citant Ichikawa et ses collègues :"Les chercheurs qui observent des clusters à l'échelle nanométrique doivent également être prudents dans l'interprétation de leurs résultats expérimentaux lorsqu'ils utilisent des cellules fixes. Nous recommandons aux chercheurs d'utiliser autant que possible des cellules vivantes pour éviter l'effet de fixation lors de l'étude de clusters à l'échelle nanométrique."
Le principe général de la microscopie à force atomique (AFM) est de faire en sorte qu'une très petite pointe balaye la surface d'un échantillon. Lors de ce balayage horizontal (xy), la pointe, qui est attachée à un petit porte-à-faux, suit le profil vertical (z) de l'échantillon, induisant une force sur le porte-à-faux qui peut être mesurée. L'amplitude de la force à la position xy peut être liée à la valeur z; les données xyz générées lors d'un balayage se traduisent ensuite par une carte de hauteur fournissant des informations structurelles sur l'échantillon étudié. L'AFM n'est pas affecté par la limite de diffraction due à l'utilisation de faisceaux lumineux ou d'électrons et peut observer la topographie de surface intacte avec une haute résolution. Affectation de caractéristiques mobiles en microscopie à force atomique à grande vitesse