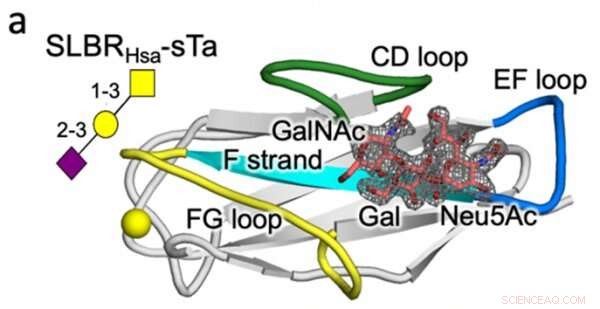
Structure cristalline d'un streptocoque SLBR (Hsa) se liant avec une haute affinité au récepteur glycane de la cellule hôte (sTa). La variation de la séquence et de la structure des boucles protéiques SLBR marquées (CD, EF et FG) est prévue pour contrôler la sélectivité de liaison au récepteur. Crédit :Université Vanderbilt
Les bactéries présentes dans notre corps se lient à divers récepteurs de surface des cellules hôtes, ce qui détermine où vivent les bactéries et comment elles se comportent. Ces récepteurs, constitués de chaînes de molécules de sucre appelées glycanes, sont plus qu'il n'y paraît. Les cellules présentes dans des états pathologiques progressifs comme le cancer peuvent avoir un nombre accru de récepteurs glycanes à leur surface.
Le laboratoire de Tina Iverson, titulaire de la chaire Louise B. McGavock et professeur de pharmacologie, a découvert le mécanisme structurel par lequel les bactéries streptocoques se lient aux glycanes des cellules hôtes, ouvrant la porte à de nouvelles façons d'utiliser les molécules bactériennes pour détecter potentiellement les cellules cancéreuses.
Des recherches antérieures ont montré que des bactéries telles que les streptocoques utilisent des molécules adhésives appelées SLBR pour se lier aux récepteurs glycanes à la surface des cellules hôtes. Le laboratoire Iverson a émis l'hypothèse que ces bactéries pourraient adapter la structure de leurs SLBR pour se lier à un large éventail de récepteurs glycanes hôtes afin de les aider à occuper de nouvelles niches dans le corps.
En ce qui concerne l'ingénierie des protéines, le laboratoire Iverson a déterminé quels éléments structurels du SLBR contrôlent le choix de la liaison au récepteur de la cellule hôte. En modifiant artificiellement l'ADN codant pour les SLBR et en purifiant les protéines résultantes des bactéries, ils ont découvert que trois boucles dans le SLBR, appelées CD, EF et FG, contrôlent les glycanes auxquels les bactéries vont se lier.
La fixation bactérienne aux récepteurs de la cellule hôte est la première étape de l'infection. Comprendre le mécanisme derrière ce processus peut également aider les chercheurs à identifier les cellules enrichies en glycanes de surface qui existent dans les états pathologiques.
Dans le cadre de cette étude, le laboratoire Iverson a découvert que les bactéries commensales de la bouche se lient à une protéine de la bouche enrobée de sucre ou glycosylée qui est également surreprésentée dans les cellules cancéreuses très agressives de la plupart des carcinomes. En développant des techniques qui modifient la sélectivité des glycanes SLBR, Iverson est déterminé à s'attaquer à un nouvel objectif à long terme :développer des réactifs capables d'identifier des cancers très agressifs. Les glycanes que les cellules expriment peuvent servir de biomarqueurs pour aider les médecins à cibler les maladies pour une intervention thérapeutique.
"Nous travaillons à élargir une bibliothèque d'agents de liaison aux glycanes que nous avons développés dans cette étude pour nous permettre de détecter une plus grande gamme de glycanes", a déclaré Iverson, également professeur de biochimie. "A terme, nous aimerions le développer en kits de diagnostic."
L'étude "Les origines de la sélectivité des glycanes dans les adhésines de type streptococcal Siglec suggèrent des mécanismes d'adaptation des récepteurs" a été publiée dans Nature Communications en mai 2022. + Explorer plus loin