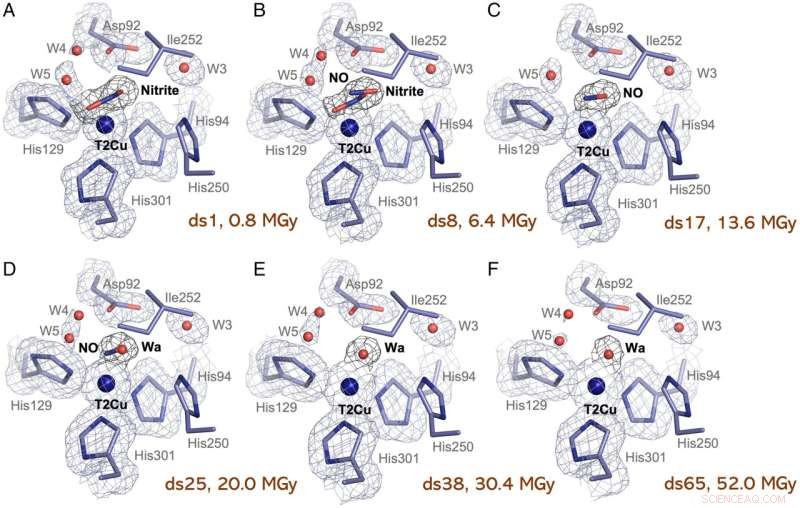
Site T2Cu pendant la série MSOX d'un Br 2D imbibé de nitrite Cristal NiR. (A) Le site T2Cu après la première exposition aux rayons X de 0,8 MGy (DS1) montrant la pleine occupation d'un seul nitrite latéral coordonné à T2Cu, Asp92 en position proximale et deux eaux de canal (W4 et W5). Ile252 et His250 ne montrent aucun changement. (B) Le site T2Cu dans DS8 (6,4 MGy) montrant des occupations égales de nitrite et de NO. Aucun autre changement n'est visible. (C) Le site T2Cu dans DS17 (13,6 MGy) montrant la pleine occupation d'un seul côté NO coordonné à T2Cu. W4 a maintenant disparu. (D) Le site T2Cu dans DS25 (20 MGy) montrant des occupations égales de NO et d'eau (Wa). W4 est maintenant de retour. (E) Le site T2Cu dans DS38 (30,4 MGy) montrant la pleine occupation d'une seule eau coordonnée à T2Cu, imitant le site T2CuII oxydé dans d'autres CuNiRs prototypes. Aucun autre changement n'est visible. (F) Le site T2Cu dans l'ensemble de données final de la série MSOX liée au nitrite (DS65), après un total de 50 MGy, montrant l'eau unique (Wa) toujours coordonnée à T2Cu. Asp92 montre des signes de combustion en raison du dépassement de la limite de dose dans le cristal avec une perte de densité observée. W4 et W5 ont également presque complètement disparu. Les cartes de densité électronique 2Fo - Fc des résidus sont profilées au niveau 1σ. Les cartes de densité électronique 2Fo - Fc des ligands sont profilées au niveau 0,9σ. T2Cu est représenté par une sphère bleue. Crédit :Actes de l'Académie nationale des sciences (2022). DOI :10.1073/pnas.2205664119
Une équipe internationale de scientifiques, dirigée par l'Université de Liverpool, a produit des films structuraux d'une enzyme clé impliquée dans une voie biologique de production de gaz à effet de serre qui offrent un nouvel aperçu de son activité catalytique.
L'oxyde nitreux, un gaz à effet de serre, est 300 fois plus dommageable pour la couche d'ozone que le dioxyde de carbone. Le protoxyde d'azote est un sous-produit de la voie de dénitrification, qui se produit lorsque des types particuliers de micro-organismes éliminent l'excès de nitrate ou de nitrite des écosystèmes et les reconvertissent en azote gazeux.
La première étape de ce processus implique une enzyme appelée nitrite de cuivre réductase (CuNiR), qui convertit le nitrite en gaz d'oxyde nitrique, en utilisant un électron et un proton. Récemment, un CuNiR d'une espèce de Rhizobia a été découvert avec une activité catalytique sensiblement plus faible. Cette espèce est abondante en agriculture et est un contributeur majeur à la voie de dénitrification et donc à l'oxyde nitreux.
CuNiR est une métalloprotéine, ce qui signifie qu'elle contient des ions métalliques pour fonctionner correctement, dans ce cas elle contient deux sites de cuivre, un où se produit la catalyse et un autre qui reçoit et donne un électron nécessaire à la catalyse. Les métalloprotéines sont très répandues en biologie et représentent au moins 30 % de toutes les protéines.
Des chercheurs du Royaume-Uni et du Japon ont utilisé la spectroscopie monocristalline et une approche de cristallographie aux rayons X connue sous le nom de MSOX (structures multiples à partir d'un cristal) pour produire un film moléculaire de l'enzyme afin de comprendre pourquoi l'activité est beaucoup plus faible dans ce CuNiR. La cristallographie aux rayons X est une technique importante qui permet de visualiser les détails atomiques des molécules biologiques en trois dimensions, aidant à comprendre comment elles sont assemblées, comment elles fonctionnent et comment elles interagissent. MSOX est une avancée dans ce domaine car il permet de visualiser la catalyse en temps réel.
Premier auteur, Ph.D. L'étudiant Samuel Rose a déclaré :« Cette recherche est importante pour deux raisons. Premièrement, elle nous aide à comprendre pourquoi l'activité de ce CuNiR est inférieure à celle des autres, ce qui peut aider à la future bio-ingénierie pour aider à lutter contre le réchauffement climatique. Deuxièmement, cela montre que l'approche MSOX associée à la spectroscopie monocristalline est une combinaison passionnante qui peut aider à disséquer des réactions redox complexes dans d'autres métalloenzymes fondamentales."
Le professeur Samar Hasnain, qui a dirigé la recherche à l'Université de Liverpool, a déclaré:"Ce n'est qu'en comprenant les processus biologiques et chimiques fondamentaux que nous pourrons nous attaquer aux problèmes environnementaux majeurs. L'approche développée pour cette étude serait applicable à de nombreux systèmes, y compris ceux impliqués dans la production d'hydrogène (hydrogénase), l'utilisation de l'azote (nitrogénases) et la photosynthèse (photosystème II)."
La recherche est publiée dans Proceedings of the National Academy of Sciences . Une étude révèle des informations sur une enzyme qui combat un gaz à effet de serre courant