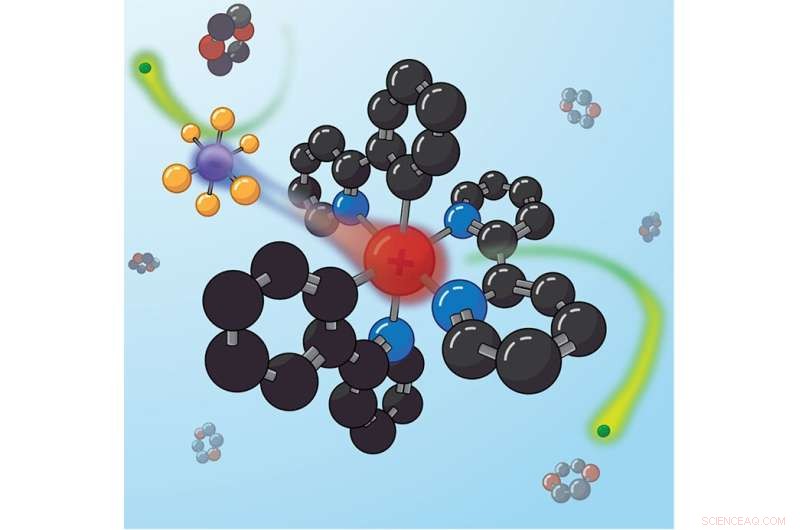
Les paires d'ions étroitement liées se réorganisent après la photoexcitation pour minimiser le moment dipolaire global, ce qui peut bloquer des types spécifiques de réactions de transfert d'électrons. Crédit :Justin Earley, NREL
Comme le poète Dylan Thomas l'a expliqué un jour, c'est "la force qui, à travers la mèche verte, entraîne la fleur".
La photochimie organique apporte la vie sur Terre, permettant aux plantes de "manger" la lumière du soleil. Utiliser ce pouvoir de la lumière pour fabriquer de nouvelles molécules en laboratoire au lieu de la feuille, du carburant aux produits pharmaceutiques, est l'un des grands défis de la recherche photochimique.
Ce qui est ancien redevient nouveau. Parfois, acquérir de nouvelles connaissances nécessite un retour aux anciens outils, avec une touche moderne. Aujourd'hui, une équipe collaborative du National Renewable Energy Laboratory (NREL) et de l'Université de Princeton a ressuscité une technique micro-ondes centenaire pour révéler une caractéristique surprenante de la chimie de la lumière bien établie.
Publié dans Chimie de la nature , "La réorganisation des paires d'ions régule la réactivité dans les catalyseurs photoredox" documente les travaux menés par Garry Rumbles, chercheur au NREL en chimie et nanosciences, le professeur de recherche Obadiah Reid et Justin Earley, étudiant diplômé de l'Université du Colorado à Boulder. Les travaux ont été réalisés dans le cadre du Renewable and Sustainable Energy Institute (RASEI), un institut commun entre le NREL et l'Université du Colorado à Boulder.
Ce travail, qui fait partie d'un centre de recherche sur les frontières de l'énergie du Département américain de l'énergie (DOE) intitulé Bioinspired Light-Escalated Chemistry (BioLEC) centré à l'Université de Princeton, révèle comment une classe importante de "catalyseurs photoredox" fonctionne, conduisant à des moyens imprévus de manipuler leur efficacité et leur sélectivité.
La catalyse photoredox est une branche de la photochimie qui a fait son retour ces dernières années, utilisant la lumière plutôt que la chaleur ou des produits chimiques hautement réactifs pour provoquer des réactions chimiques. Cela permet de conduire des réactions avec des barrières cinétiques ou thermodynamiques élevées avec un meilleur contrôle sur le produit final et des ingrédients potentiellement moins nocifs.
Cependant, pour utiliser ces nouvelles réactions à l'échelle de la fabrication, une compréhension détaillée du fonctionnement de la réaction est nécessaire.
"Nous avons commencé ce travail afin d'apprendre comment les charges se déplacent lors des réactions induites par la lumière", a déclaré Reid. "Mais nous ne nous attendions pas à ce que le premier catalyseur que nous avons étudié nous surprenne ainsi."
Le catalyseur étudié par l'équipe du NREL était un composé ionique composé de deux moitiés. Une moitié était chargée positivement et l'autre était négative, de sorte que la charge globale s'ajoutait à zéro. Dans ce cas, on pensait que le côté positif faisait tout le travail dans les réactions chimiques induites par la lumière, tandis que le côté négatif était un "contre-ion" supposément inerte.
"Nous avons découvert que le contre-ion se déplace réellement lorsque le catalyseur est excité par la lumière et qu'il peut bloquer certains types de réactions", a déclaré Reid. "Comme un secondeur, parfois votre travail consiste simplement à vous gêner. C'est exactement ce que fait le contre-ion."
En mesurant exactement comment leur signal micro-ondes changeait lorsqu'il traversait la solution - avec et sans lumière - l'équipe a montré que le contre-ion chargé négativement se déplaçait après que la molécule ait été excitée par la lumière. "C'est important", a déclaré Earley, "parce que les molécules ont besoin d'un chemin pour que les électrons se déplacent afin d'initier une réaction chimique, et le contre-ion peut la bloquer." L'équipe a découvert que l'action bloquante du contre-ion entraînait un changement d'un facteur quatre entre deux types de réactions différents.
Rumbles a déclaré que bien que l'outil de mesure utilisé par l'équipe NREL existe depuis plus de 100 ans, les scientifiques devaient historiquement mener des expériences de contrôle chronophages pour interpréter leurs résultats. Les ordinateurs ont changé cela. Au lieu de cela, l'équipe NREL a utilisé des simulations quantitatives de la façon dont les molécules de catalyseur tournent en solution pour aider à interpréter leurs résultats. Rendre des molécules stables réactives avec la lumière