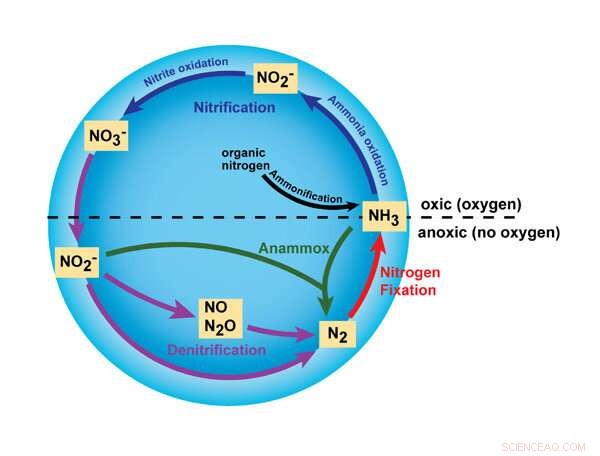
Ce graphique met en évidence certaines des principales réactions du cycle de l'azote, déclenchées par l'utilisation d'ammoniac, ou NH3 , les engrais. La nouvelle recherche de MSU se concentre sur les réactions impliquant le nitrite (NO2 -), monoxyde d'azote (NO) et protoxyde d'azote (N2 O). Droits d'auteur : Éducation à la nature, 2010
L'azote peut ne pas recevoir le même niveau d'attention que ses voisins du tableau périodique, le carbone et l'oxygène. Mais comme ses voisins, c'est un élément dont on ne peut se passer.
Les composés azotés jouent un rôle important en biologie, notamment en abaissant la tension artérielle, en aidant à relayer les signaux dans notre corps et en nourrissant les plantes. En fait, les engrais industriels riches en azote ont effectivement doublé la capacité de production alimentaire mondiale.
Pourtant, trop de n'importe quoi peut être mauvais, et l'azote ne fait pas exception. Par exemple, lorsque la pluie entraîne l'excès d'engrais loin des champs et dans les lacs, les rivières et d'autres plans d'eau, les composés nutritifs qu'ils contiennent peuvent alimenter des populations croissantes de microbes qui peuvent étouffer ou empoisonner les écosystèmes naturels.
Les impacts sous-jacents de l'azote, utiles et nocifs, sont ce qu'on appelle le cycle de l'azote. C'est le nom collectif des processus chimiques que les systèmes biologiques et géologiques de la nature utilisent pour décomposer les composés azotés et transporter les produits dans l'environnement. Bien que la science ait développé une grande partie de la vue d'ensemble du cycle de l'azote, Timothy Warren de la Michigan State University et son équipe approfondissent maintenant ses détails chimiques fondamentaux.
L'équipe a récemment publié deux nouveaux rapports à ce sujet dans deux revues de chimie différentes :Nature Chemistry et le Journal de l'American Chemical Society (JACS ).
Ce que Warren et son équipe ont récemment découvert ne fournira aucune solution immédiate pour, par exemple, fabriquer et utiliser des engrais de manière plus durable. Mais les chercheurs créent une compréhension plus intime du cycle de l'azote qui pourrait conduire à des solutions holistiques pour assurer un équilibre sain de l'azote, partout où cela est nécessaire.
En attendant, les articles rappellent également que la nature est encore pleine de mystères conséquents, dont certains sont antérieurs aux humains et aux plantes.
"Nous sommes très inspirés par ce que nous trouvons dans la nature, mais nous essayons de comprendre les comportements de la nature que nous n'avons pas encore détectés", a déclaré Warren, professeur Barnett Rosenberg et directeur du département de chimie de le Collège des sciences naturelles.
"Il y a le dogme établi du fonctionnement des choses, mais en creusant un peu plus et en essayant d'aller au-delà, on ouvre la science à des surprises."
En plus de découvrir quelques nouvelles révélations, les deux articles aident à décrire le cycle de l'azote avec plus de détails et de précision qu'auparavant. Malgré leurs similitudes, cependant, ils ont également des implications différentes.
Alchimie primordiale avec un "nitro boost"
Au risque de trop simplifier tout un domaine scientifique, la chimie s'intéresse à la façon dont les atomes sont échangés et réarrangés lorsque différents participants moléculaires sont impliqués. Certaines des interactions les plus intrigantes sont celles qui sont essentielles à la vie, celles qui améliorent notre qualité de vie ou celles qui aident les scientifiques à mieux comprendre comment fonctionne la vie sur cette planète.
Les réactions du cycle de l'azote peuvent cocher les trois cases, comme en témoignent celles mises en évidence dans les articles de l'équipe Warren.
"Ces deux rapports fournissent de nouvelles informations fondamentales sur les molécules qui sont des éléments importants du cycle biogéochimique de l'azote. Ce cycle est essentiel au fonctionnement et à la santé des écosystèmes", a déclaré Warren. "Ce que nous faisons, c'est scruter les molécules de nouvelles manières pour mieux comprendre leur lien avec ce cycle."
En particulier, l'article JACS de l'équipe met en lumière une nouvelle voie que la nature peut utiliser pour convertir l'oxyde nitrique en oxyde nitreux, deux molécules importantes à part entière.
L'oxyde nitrique, composé d'un atome d'azote et d'un atome d'oxygène, a été nommé "molécule de l'année" en 1992 par le magazine Science. Et les gens peuvent reconnaître le protoxyde d'azote, qui contient deux atomes d'azote et un oxygène, grâce à son rôle principal dans le gaz hilarant ou à son rôle de soutien en tant que "nitro boost" dans la franchise de films "Fast and Furious".
Encore une fois, l'équipe de Warren est consciente des applications des molécules, mais les chercheurs sont motivés par ce que ces réactions révèlent à un niveau chimique plus fondamental. Le JACS Le papier, par exemple, révèle que l'oxyde nitrique est étonnamment apte à accepter les électrons d'autres réactifs.
Dans de bonnes conditions, le protoxyde d'azote peut également être un bon accepteur d'électrons, mais l'oxygène fournit une norme inébranlable dans ce domaine. C'est pourquoi les chimistes se réfèrent à ces composés accepteurs d'électrons en tant qu'oxydants, oxydants et agents oxydants. Les oxydants provoquent la rouille du métal, mais ils sont également essentiels à de nombreuses réactions biologiques et industrielles importantes.
Mais l'oxygène n'était pas une denrée facilement disponible dans l'atmosphère terrestre jusqu'à ce que la planète ait quelques milliards d'années. C'est à ce moment-là que les premiers microbes ont commencé à l'émettre, les plantes emboîtant ensuite le pas grâce à la photosynthèse.
"La nature faisait de la chimie d'oxydation avant le grand événement d'oxydation, avant le début de la photosynthèse", a déclaré Warren. "Cela signifie que l'oxyde nitrique et les composés azotés apparentés étaient probablement des oxydants importants dans la vie primordiale, avant que la Terre n'ait beaucoup d'oxygène.
"Il s'avère que la nature a développé des enzymes qui peuvent faire cette chimie d'oxydation avec ces composés", a-t-il déclaré. "Cet article fournit de nouvelles informations sur la façon dont la nature les utilise aujourd'hui et peut-être même avant que l'oxygène ne soit abondant."
L'histoire d'une molécule brisée
L'équipe Chimie Nature article axé sur une partie différente du cycle de l'azote, qui commence par un composé appelé nitrite, une molécule chargée négativement constituée d'un atome d'azote lié à deux atomes d'oxygène.
Le nitrite apparaît dans de nombreux endroits, dont beaucoup reflètent la dualité de l'azote. Le nitrite se trouve dans les engrais qui aident les plantes à pousser. C'est aussi dans le ruissellement qui pollue les écosystèmes aquatiques.
Le nitrite se trouve naturellement à des niveaux sains dans les fruits et légumes. Dans le même temps, les médecins recommandent de limiter notre consommation de viandes transformées, dans lesquelles les sels de nitrite sont utilisés comme conservateurs à des niveaux relativement élevés.
En ce qui concerne le nitrite, la différence entre l'avantage et le fardeau est liée au dosage, mais aussi à la question de savoir si et comment il est métabolisé ou converti en d'autres composés. Cela signifie qu'avec une meilleure compréhension du cycle de l'azote, la chimie pourrait aider à atténuer les effets nocifs du nitrite en développant des enzymes ou d'autres outils catalytiques qui le placent sur la voie de produits en aval plus bénéfiques. Notamment, cela inclut l'oxyde nitrique, "Molécule de l'année" en 1992.
Les microbes du sol ont des enzymes qui convertissent le nitrite en oxyde nitrique dans un ensemble hautement chorégraphié d'interactions chimiques qui se produisent en même temps. L'équipe de Warren a trouvé un moyen de diviser ce processus en une affaire séquentielle par étapes. Trouver cette approche synthétique pour imiter la nature permettra aux chimistes de mieux sonder différents aspects de la réaction.
Cela aidera les chimistes à être plus délibérés dans la conception de catalyseurs qui peuvent faire des choses comme aider à décomposer les nutriments des engrais avant qu'ils n'atteignent les cours d'eau naturels. Cela ouvre également des applications plus éloignées du rôle de l'azote dans la nature, a déclaré Warren, comme dans le stockage à long terme des déchets nucléaires où les nitrites sont présents. Dans son étude, l'équipe a également découvert une nouvelle chimie qui pourrait même aider à améliorer les notes de premier cycle.
"Dans chaque cours de chimie générale, que vous le suiviez à la MSU ou ailleurs, vous apprenez que le nitrite est un anion avec une charge électrique de -1. Mais si on lui attribue accidentellement une charge de -2, nous avons trouvé un moyen cela montre que cela peut aussi être vrai", a déclaré Warren.
"Nous avons révélé une nouvelle molécule fondamentale dans la nature :le nitrite avec une charge -2. Il n'y a pas eu beaucoup de discussions à ce sujet auparavant, sauf en tant qu'espèce éphémère dans les déchets nucléaires ou peut-être lorsque les étudiants se trompent aux examens." Les chercheurs demandent plus de travail pour équilibrer le cycle de l'azote