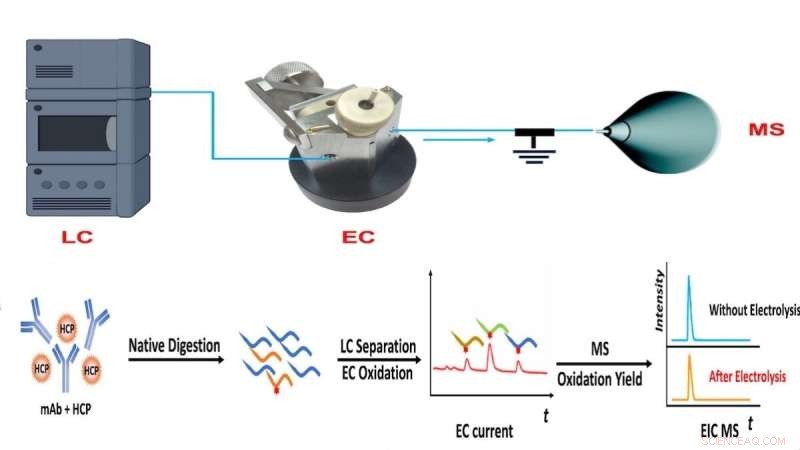
Flux de travail de la méthode CMS de l'équipe NJIT, combinant la chromatographie liquide (LC), l'oxydation électrochimique (EC) et la mesure quantitative basée sur la spectrométrie de masse (MS) de l'abondance des protéines. Crédit :NJIT
Des chercheurs du New Jersey Institute of Technology (NJIT) ont dévoilé une nouvelle technique de laboratoire qui, selon eux, représente un "changement de paradigme" dans la façon dont les laboratoires pharmaceutiques testent et produisent de nouveaux médicaments à base de protéines, tels que des anticorps monoclonaux thérapeutiques développés pour traiter une variété de maladies, des cancers aux maladies infectieuses.
Les chercheurs disent que leur approche basée sur l'électrochimie, décrite dans la revue Analytical Chemistry , pourrait permettre de tester la sécurité et la qualité des produits biothérapeutiques prometteurs en une fraction du temps requis par les méthodes conventionnelles, qui nécessitent généralement la production longue et coûteuse de certains biomatériaux utilisés pour les tests d'échantillons.
L'étude a été menée en collaboration avec des chercheurs de Merck, Johnson &Johnson et de l'Université de l'Ohio.
« Cette méthode que nous avons développée au NJIT a le potentiel d'avoir un impact majeur sur la protéomique quantitative, et elle représente un changement de paradigme dans l'industrie pharmaceutique en termes de surveillance des produits biopharmaceutiques et des impuretés de processus pour le contrôle de la qualité », a déclaré Hao Chen, directeur du journal. auteur correspondant et professeur au Département de chimie et des sciences de l'environnement du NJIT.
"Avec cette étude, nous avons maintenant démontré une approche qui peut quantifier le produit médicamenteux et traiter les impuretés beaucoup plus rapidement et avec précision que cela n'avait été possible.… Nous nous attendons à ce qu'elle devienne très utile pour faciliter le développement de protéines thérapeutiques et de vaccins pour le traitement et la prévention de différentes maladies à l'avenir."
Traditionnellement, ces tests, ou quantification des protéines, impliquent la préparation fastidieuse de peptides synthétiques marqués par des isotopes qui sont utilisés comme étalons internes pour mesurer les concentrations totales de protéines dans un échantillon, ce qui aide les chercheurs à surveiller activement l'efficacité et l'innocuité des composants protéiques thérapeutiques tout au long du développement du médicament. processus.
Pour surmonter cette limitation, le laboratoire de Chen a développé une approche de spectrométrie de masse coulométrique (CMS) pour la quantification absolue des protéines sans l'utilisation de normes. La méthode applique à la place la chromatographie liquide-spectrométrie de masse et une cellule à flux électrochimique pour quantifier et détecter rapidement les changements dans les protéines ou peptides cibles en fonction des signatures électrochimiques.
« Au lieu d'attendre des semaines pour obtenir des normes ou des réactifs dans les approches traditionnelles, on pourrait effectuer immédiatement des expériences de quantification CMS. Ainsi, cela faciliterait le suivi des impuretés médicamenteuses découvertes au cours du processus et garantirait leur élimination efficace avec l'optimisation et le contrôle du processus », a déclaré Chen.
"Un tel appareil nous permet de séparer les peptides après la digestion des protéines par chromatographie liquide, de surveiller l'oxydation des peptides dans la cellule à flux électrochimique pour produire un courant électrique et de mesurer le rendement d'oxydation avec la spectrométrie de masse", a expliqué le premier auteur de l'article et NJIT Ph.D. . étudiant Yongling Ai. "La combinaison des signaux de courant électrique avec le rendement d'oxydation fournit des informations suffisantes pour la quantification absolue des peptides et des protéines."
Dans leur étude, l'équipe a démontré sa méthode CMS en réalisant une quantification absolue de plusieurs protéines (β-lactoglobuline B, α-lactalbumine et anhydrase carbonique) dans un mélange en une seule passe, sans utiliser de normes.
Notamment, l'équipe a également présenté les capacités de la méthode pour détecter la désamidation des protéines, un événement de dégradation courant des protéines thérapeutiques résultant de contraintes physiques ou chimiques tout au long du processus de fabrication et de stockage.
L'équipe a réussi à quantifier plusieurs produits de dégradation des protéines, y compris un intermédiaire clé de la dégradation des protéines, la formation de succinimide, ce qui n'avait jamais été fait auparavant avec une quantification absolue en raison du manque de normes, selon les auteurs de l'étude.
"Le manque de normes est causé par les défis de leur synthèse de novo", a déclaré Chen. "Être capable de quantifier avec précision les produits et intermédiaires de désamidation pourrait permettre de mieux comprendre la dégradation des protéines thérapeutiques et potentiellement créer une nouvelle façon d'étudier les pathologies des maladies et les processus de vieillissement."
Maintenant, le laboratoire de Chen prévoit d'appliquer sa nouvelle méthode pour la quantification à grande échelle de milliers de protéines en une seule fois. Ils prévoient également d'améliorer la sensibilité de leur analyse CMS pour permettre de quantifier de très faibles niveaux de protéines dans des échantillons biologiques complexes, ce qui pourrait bénéficier aux efforts de recherche allant du diagnostic clinique et de la découverte de médicaments à la médecine de précision pour laquelle l'identification et la quantification des échantillons au niveau moléculaire est nécessaire.
"Comme les protéines remplissent une vaste gamme de fonctions au sein des organismes, l'importance de la quantification absolue des protéines est difficile à surestimer", a déclaré Chen. "CMS devrait accélérer les processus de diagnostic des maladies, de découverte et de développement de médicaments, et il ouvre désormais une nouvelle porte aux biologistes et aux biochimistes pour explorer les quantités de protéines dans le corps humain qui peuvent remplir des fonctions biologiques importantes ou des rôles de biomarqueurs de maladies et de cibles médicamenteuses. " Les chercheurs développent un moyen plus simple et plus rapide de quantifier et d'explorer les protéines thérapeutiques