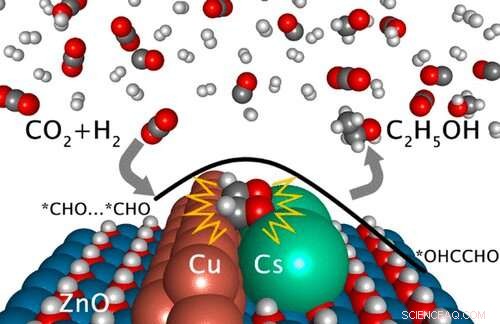
Résumé graphique. Crédit :DOI :10.1021/jacs.1c03940
Une collaboration internationale de scientifiques a franchi une étape importante vers la réalisation d'une technologie presque « verte » à zéro carbone net qui convertira efficacement le dioxyde de carbone, un gaz à effet de serre majeur, et de l'hydrogène en éthanol, qui est utile comme carburant et a de nombreuses autres applications chimiques. L'étude présente une "feuille de route" pour naviguer avec succès dans cette réaction difficile et fournit une image de la séquence complète de la réaction à l'aide d'une modélisation théorique et d'une caractérisation expérimentale.
Dirigé par le laboratoire national de Brookhaven du Département de l'énergie des États-Unis (DOE), le groupe a déterminé qu'apporter du césium, le cuivre, et l'oxyde de zinc ensemble dans une configuration de contact étroit catalyse une voie de réaction qui transforme le dioxyde de carbone (CO
Aucun des trois composants examinés dans l'étude n'est capable de catalyser individuellement le CO
"Il y a eu beaucoup de travail sur la conversion du dioxyde de carbone en méthanol, pourtant, l'éthanol présente de nombreux avantages par rapport au méthanol. Comme carburant, l'éthanol est plus sûr et plus puissant. Mais sa synthèse est très difficile en raison de la complexité de la réaction et de la difficulté de contrôler la formation de liaisons C-C, " a déclaré le chercheur correspondant de l'étude, Ping Liu, chimiste de Brookhaven. « Nous savons maintenant quel type de configuration est nécessaire pour effectuer la transformation, et les rôles que chaque composant joue au cours de la réaction. C'est une grande avancée."
L'interface est formée en déposant d'infimes quantités de cuivre et de césium sur une surface d'oxyde de zinc. Pour étudier les régions où les trois matériaux se rencontrent, le groupe s'est tourné vers une technique aux rayons X appelée spectroscopie de photoémission X, qui a montré un changement probable dans le mécanisme de réaction pour le CO
L'une des choses qu'ils ont apprises de la modélisation est que le césium est un composant vital du système actif. Sans sa présence, l'éthanol ne peut pas être fabriqué. En outre, une bonne coordination avec le cuivre et l'oxyde de zinc est également importante. Mais il y a beaucoup plus à apprendre.
« Il y a de nombreux défis à surmonter avant d'arriver à un processus industriel qui peut transformer le dioxyde de carbone en éthanol utilisable, " a déclaré le chimiste de Brookhaven José Rodriguez, qui a participé aux travaux. "Par exemple, il doit y avoir un moyen clair d'améliorer la sélectivité envers la production d'éthanol. Un enjeu clé est de comprendre le lien entre la nature du catalyseur et le mécanisme réactionnel; cette étude est en première ligne de cet effort. Nous visons une compréhension fondamentale du processus."
Un autre objectif de ce domaine de recherche est de trouver un catalyseur idéal pour le CO
Les chercheurs ont prévu des études de suivi à Brookhaven's National Synchrotron Light Source II, également une installation d'utilisateurs du DOE Office of Science, qui offre une suite unique d'outils et de techniques pour la caractérisation des catalyseurs en conditions de travail. Là, ils étudieront plus en détail le système Cu-Cs-ZnO et les catalyseurs de composition différente.