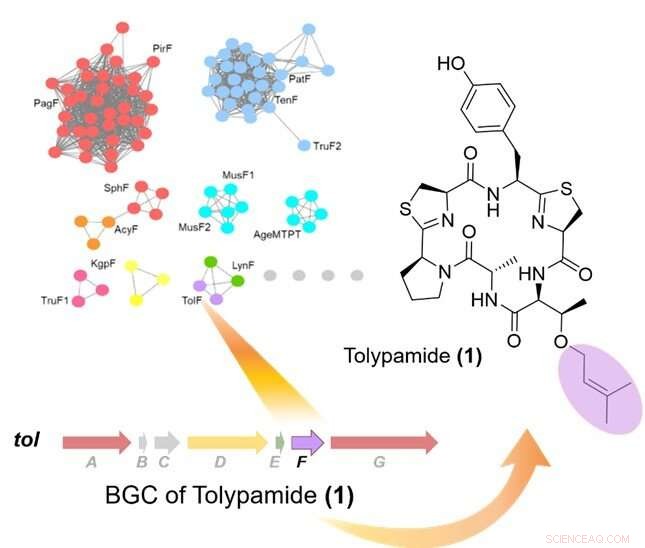
Figure 1 :L'extraction ciblée du génome des prényltransférases a identifié l'enzyme TolF et le tol cluster de gènes biosynthétiques (BGC). Le coin supérieur gauche montre un réseau de similarité de séquences protéiques de prényltransférases. Le groupe de gènes biosynthétiques pour le tol est montrée et était liée à la biosynthèse du tolypamide. Le tolypamide contient un résidu thréonine prénylé avant (coloré en violet). Crédit :Université nationale de Singapour
Des chercheurs de NUS ont utilisé une approche d'exploration du génome pour identifier un nouveau peptide cyclique (tolypamide) dérivé d'une cyanobactérie. La biosynthèse du tolypamide comporte un nouveau type d'enzyme capable de prényler une gamme de substrats et a une utilisation potentielle en chimie pharmaceutique et en biologie synthétique.
Les peptides bioactifs se sont imposés sur le marché pharmaceutique en raison de leurs nombreux avantages tels qu'un ciblage efficace des interactions protéine-protéine, faibles effets hors cible, et une faible toxicité. Ces avantages sont souvent compromis en raison d'une faible biodisponibilité et d'une faible perméabilité cellulaire. Une façon d'améliorer la perméabilité membranaire est d'augmenter la lipophilie en ajoutant une chaîne alkyle à la molécule (prénylation). Ces métamorphoses, qui peut être catalysée par des enzymes impliquées dans la biosynthèse des produits naturels de la cyanobactine, peut potentiellement augmenter l'efficacité thérapeutique des peptides non modifiés. Aussi, les enzymes cyanobactine ont une large sélectivité de substrat et agissent de manière hautement sélective et spécifique en ce qui concerne la position et l'orientation des résidus d'acides aminés. Comprendre la raison d'être de la sélectivité et de la spécificité de ces catalyseurs aidera à exploiter la capacité de ces enzymes en tant que trousses d'outils biochimiques.
En collaboration avec une équipe de recherche internationale, Pr Brandon Morinaka du Département de Pharmacie, L'Université nationale de Singapour a découvert un nouveau type d'enzyme cyanobactine connue sous le nom de ToIF. Il présente une sélectivité spécifique pour la modification des résidus sérine et thréonine dans les peptides. Ce travail est un effort de recherche conjoint avec le Pr Eric Schmidt de l'Université de l'Utah et le Dr Muriel Gugger de l'Institut Pasteur. Les protéines d'une sous-famille de prényltransférases ont été cartographiées dans un réseau de similarité de séquences.
Les chercheurs ont appliqué l'exploration ciblée du génome pour analyser les groupes de gènes codant pour ces protéines et identifié l'enzyme ToIF et la voie de biosynthèse tol. Ils ont découvert que l'enzyme TolF est impliquée dans la production de tolypamide qui possède un groupe fonctionnel prényle hydrophobe attaché à sa structure (Figure 1). De tels attachements moléculaires sont utiles pour améliorer la perméabilité membranaire de composés thérapeutiques. L'enzyme TolF a été validée fonctionnellement par biosynthèse in vitro du produit naturel tolypamide (Figure 2). Des dosages biochimiques supplémentaires montrent que l'enzyme TolF est également capable de faciliter la prénylation directe sur les résidus thréonine et sérine sur divers peptides synthétiques.
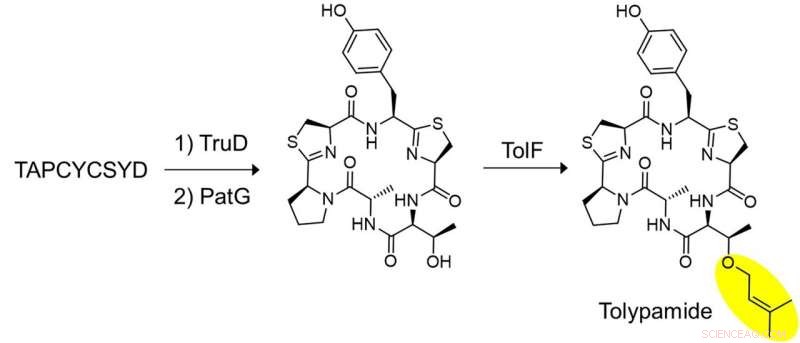
Figure 2 :Biosynthèse in vitro du tolypamide et validation fonctionnelle du TolF. Un ensemble clé d'expériences a été réalisé pour montrer que TolF agit sur le peptide cyclique hétérocyclisé. Le peptide synthétisé, TAPCYCSYD a été incubé séquentiellement avec les enzymes, TruD (hétérocyclase) et PatG (macrocyclase) pour fournir le peptide cyclique hétérocyclisé. L'incubation avec TolF a donné une conversion quantitative au produit naturel tolypamide. Crédit :Université nationale de Singapour
À ce jour, le seul autre membre de cette classe d'enzymes (prényltransférase) identifié pour agir sur les résidus sérine ou thréonine est TruF1. Cependant, sa faible solubilité et sa faible activité in vitro ont empêché une caractérisation approfondie. La découverte de TolF offre l'opportunité d'étudier la biologie structurale et l'évolution de cette famille d'enzymes.
Le professeur Morinaka a dit, "Une caractérisation plus poussée de l'enzyme TolF permettra une compréhension plus complète de la spécificité du substrat et de la sélectivité des prényltransférases. Cela facilitera l'ingénierie rationnelle de ces biocatalyseurs en tant qu'outils puissants dans le domaine de la biologie synthétique."