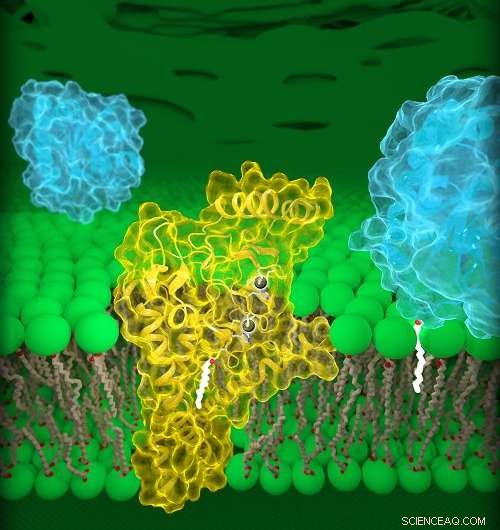
La DHHC20 humaine (jaune) est incrustée dans la membrane de Golgi (verte), un compartiment situé à l'intérieur des cellules. DHHC20 attache une chaîne d'acides gras (blanche) à une protéine cible (bleu, premier plan), qui ancre la protéine à la membrane de Golgi. Crédit :Jeremy Swan, NICHD/NIH
La première structure tridimensionnelle des protéines DHHC—enzymes impliquées dans de nombreux processus cellulaires, y compris le cancer - explique comment ils fonctionnent et peut offrir un modèle pour la conception de médicaments thérapeutiques. Des chercheurs ont proposé de bloquer l'activité de la DHHC pour augmenter l'efficacité des traitements de première intention contre les formes courantes de cancer du poumon et du sein. Cependant, il n'existe actuellement aucun médicament autorisé qui cible des enzymes DHHC spécifiques. L'étude, dirigé par des chercheurs de l'Institut national Eunice Kennedy Shriver pour la santé de l'enfant et le développement humain (NICHD), apparaît dans le dernier numéro de Science .
Enzymes DHHC, aussi appelées palmitoyltransférases, modifier d'autres protéines en leur attachant une chaîne de lipides, ou des acides gras, de longueurs variables. Cette modification, appelé palmitoylation, peut modifier de nombreuses propriétés d'une protéine cible, comme sa structure, fonction et emplacement dans une cellule. Les chercheurs estiment que près de 1, 000 protéines humaines subissent une palmitoylation, y compris les récepteurs du facteur de croissance épidermique (EGFR). Un EGFR bien connu est HER2, qui est suractivé dans les formes agressives de cancer du sein. Les EGFR peuvent également être suractivés dans le cancer du côlon, et le cancer du poumon non à petites cellules, le type le plus courant de cancer du poumon.
L'étude actuelle détaille les structures d'une enzyme DHHC humaine, DHHC20, et la version poisson zèbre d'une autre enzyme DHHC, DHHC15. Surtout, La DHHC20 est l'enzyme qui palmitoyle l'EGFR. Des études antérieures ont montré que le blocage de DHHC20 rend les cellules cancéreuses plus vulnérables aux traitements existants approuvés par la FDA qui ciblent l'EGFR. Par conséquent, comprendre la structure de DHHC20 peut être important pour le traitement des cancers induits par l'EGFR.
"Les mutations des enzymes DHHC sont associées à divers cancers et troubles neurologiques, " selon Anirban Banerjee, Doctorat., l'auteur principal de l'étude et le chef de l'unité du NICHD sur la biologie structurale et chimique des protéines membranaires. "Notre étude offre un point de départ pour le développement d'inhibiteurs de la DHHC20 qui peuvent aider au traitement des cancers courants et faire progresser le domaine de la palmitoylation des protéines."
Le Dr Banerjee et ses collègues ont identifié une composante structurelle, une cavité, de DHHC20 qui influence la longueur de sa chaîne lipidique. Des mutations qui ont modifié la taille relative de cette cavité ont amené DHHC20 à utiliser des chaînes lipidiques plus ou moins longues, qui modifie vraisemblablement les effets de la palmitoylation sur une protéine cible. Les chercheurs proposent que la structure de ce site explique pourquoi différentes enzymes DHHC utilisent certaines chaînes lipidiques pour modifier les fonctions d'autres protéines. Il offre également un aperçu de la façon dont plusieurs enzymes fonctionnent ensemble dans des états de santé et de maladie.