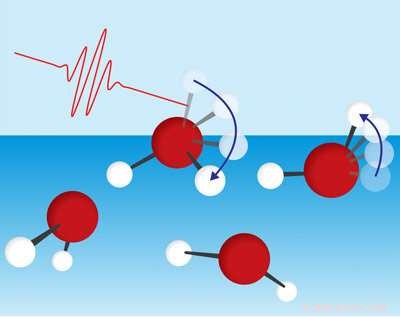
Figure 1 :Contrairement aux autres molécules d'eau (sphères rouges :atomes d'oxygène; sphères blanches :atomes d'hydrogène), ceux à la surface ont un groupe hydroxyle libre (OH). Tahei Tahara et son équipe ont utilisé la spectroscopie ultrarapide (indiquée par un photon rouge) pour montrer que la principale façon dont ces groupes OH libres perdent de l'énergie est la rotation (indiquée par des flèches bleues). Crédit :Laboratoire de spectroscopie moléculaire RIKEN
Les réactions chimiques et les processus physiques qui impliquent les surfaces d'eau seront plus faciles à modéliser grâce à la découverte par une équipe entièrement constituée de RIKEN de la façon dont les molécules à la surface de l'eau perdent de l'énergie.
L'eau est anormale à bien des égards. Par exemple, il a des points de congélation et d'ébullition beaucoup plus élevés que ce à quoi on pourrait s'attendre sur la base d'une comparaison naïve avec d'autres hydrures. La plupart de ces propriétés anormales proviennent de la forte attraction électrostatique qu'un atome d'hydrogène ressent pour un atome d'oxygène dans une molécule voisine. Cette force d'attraction donne lieu à des liaisons hydrogène entre les molécules d'eau voisines.
Ces liaisons hydrogène forment un réseau 3D au sein d'un plan d'eau. Mais la couche de molécules située à la surface de l'eau diffère des autres molécules en ce qu'elle ne forme des liaisons hydrogène qu'avec les molécules situées en dessous. Parce que cette couche n'a qu'une molécule d'épaisseur, on n'en sait pas grand chose.
Maintenant, Tahei Tahara du laboratoire de spectroscopie moléculaire RIKEN et ses collègues ont découvert comment ces molécules de surface perdent de l'énergie.
"Les interfaces de l'eau jouent un rôle clé dans de nombreux processus chimiques et physiques fondamentaux, " dit Tahara. " Il est donc crucial de comprendre comment l'eau interfaciale dissipe l'énergie pour comprendre et contrôler les phénomènes interfaciaux au niveau moléculaire. "
Les molécules d'eau de surface ont un groupe hydroxyle (OH) qui dépasse dans l'air, qui est exempt du réseau de liaisons hydrogène. L'équipe a découvert que les molécules d'eau de surface dissipent principalement l'énergie en faisant tourner cette liaison OH saillante (Fig. 1). Cela va à l'encontre des idées reçues, à savoir que les molécules de surface ne perdent de l'énergie qu'en interagissant avec les molécules voisines.
"Cette découverte va complètement à l'encontre de la croyance existante selon laquelle la dissipation d'énergie de l'OH libre procède d'un transfert d'énergie, " note Tahara.
Cette découverte mettra en lumière la dynamique de bien plus que de simples surfaces d'eau. "Nous pensons que notre découverte fournit une base pour élucider pleinement les processus dynamiques, y compris les réactions chimiques qui se déroulent à l'interface de l'eau, " dit Tahara.
Pour faire leur découverte, l'équipe a utilisé une technique spectroscopique qui distingue les molécules de surface et sonde leur évolution dans le temps. C'était une mesure difficile à faire. "Ce fut une expérience difficile et délicate à réaliser, ", explique Tahara. "Nous avons dû détecter les changements femtosecondes dans le faible signal généré à partir d'une seule couche d'eau à l'interface air-eau tout en contrôlant la phase des impulsions laser femtosecondes."
L'équipe a ensuite l'intention d'étudier comment les groupes OH liés à l'hydrogène de l'eau interfaciale transfèrent l'énergie. "Cela nous donnera une vision cohérente et cohérente des processus de transfert d'énergie aux interfaces de l'eau, " dit Tahara.