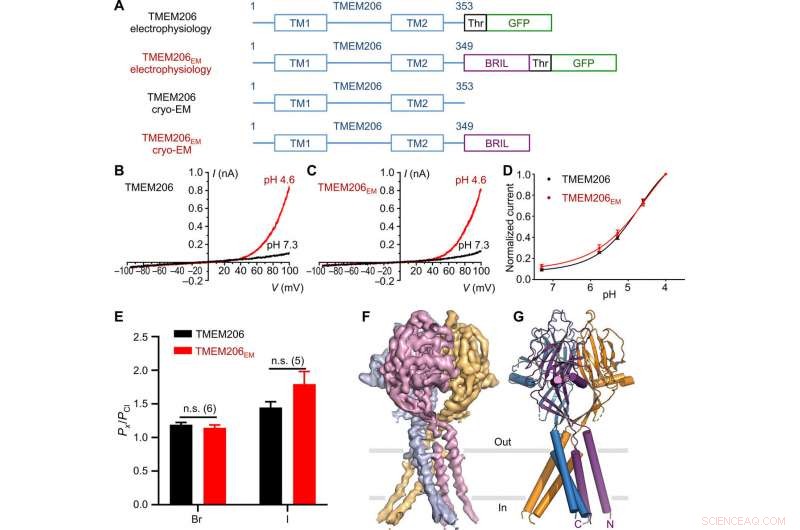
Fonction et structure du poisson-globe TMEM206. (A) Schéma des constructions de canaux utilisées pour les expériences d'électrophysiologie et de cryo-EM à une seule particule. « Thr » représente un site de clivage de la thrombine. (B et C) Traces de courant de cellules entières représentatives activées par un pH extracellulaire de 4,6 pour le poisson-globe TMEM206 (B) et TMEM206EM (C). Les constructions de canaux ont été exprimées dans des cellules 293T de rein embryonnaire humain (HEK) knock-out TMEM206. (D) Relations courant-pH normalisées du poisson-globe TMEM206 (n =6 à 9 cellules par point de données) et TMEM206EM (n =5 à 6 cellules par point de données). Tous les courants ont été enregistrés à température ambiante et normalisés à des courants de pH 4,0 à +100 mV. (E) Sélectivité anionique pour le poisson-globe TMEM206 et TMEM206EM. Les données sont présentées sous forme de moyennes ± SEM (n.s., insignifiant; test t de Student). (F) Densité cryo-EM du poisson-globe TMEM206EM profilé à 7,0 et coloré par des sous-unités individuelles. (G) Structure trimérique du poisson-globe TMEM206EM. Crédit: Avancées scientifiques , doi:10.1126/sciadv.abe5983
La protéine transmembranaire 206 abrégée en TMEM206 est un canal chlorure conservé au cours de l'évolution qui sous-tend l'expression ubiquitaire, activé par des protons, rectifiant vers l'extérieur les courants anioniques. Dans un nouveau rapport maintenant publié le Avancées scientifiques , Zengqin Deng et une équipe de recherche multidisciplinaire de la Washington University School of Medicine, à Saint-Louis, Les États-Unis ont décrit la structure de cryomicroscopie électronique (cryo-EM) du poisson-globe TMEM206. La structure formait un canal trimérique avec deux segments transmembranaires et un grand domaine extracellulaire. D'après les résultats, Deng et al. a montré comment un vaste vestibule dans la région extracellulaire pouvait être accédé latéralement à partir de trois portails latéraux, où le pore central contenait de multiples constructions. Par exemple, un résidu lysine conservé proche de la région cytoplasmique de l'hélice interne, vraisemblablement formé le filtre de sélectivité des ions chlorure. La structure et l'assemblage du noyau ressemblaient à ceux des canaux sodiques qui ne sont pas liés dans la séquence d'acides aminés, et donc conduire des cations au lieu d'anions. Avec l'électrophysiologie, ils ont fourni des informations sur la conduction ionique et le déclenchement pour une nouvelle classe de canaux chlorure qui sont architecturalement distincts des familles de canaux chlorure précédemment décrites.
Canaux ioniques chlorure
Les ions chlorure sont des anions abondants chez les animaux, et ils se déplacent à travers les membranes cellulaires via des canaux de chlorure et des transporteurs pour une variété de fonctions cellulaires, y compris la régulation du volume cellulaire, acidification intracellulaire et contrôle de l'excitabilité des muscles. Les ions sont largement observés dans les cellules de mammifères bien que les composants moléculaires derrière les courants de chlorure soient restés insaisissables jusqu'à présent. Deux études indépendantes qui ont utilisé le criblage d'interférence d'ARN à l'échelle du génome ont identifié TMEM206 comme le canal anionique sous-jacent. Le TMEM206 est conservé au cours de l'évolution chez les vertébrés. Les canaux chlorure sont divers à la fois dans la séquence d'acides aminés et dans l'architecture tridimensionnelle. Dans ce travail, Deng et al. a présenté une structure de cryo-microscopie électronique (cryo-EM) de poisson-globe TMEM206 pour révéler une architecture de canaux trimériques différente de celles précédemment connues. Les scientifiques ont combiné l'électrophysiologie avec ce travail pour fournir la première description structurelle et fonctionnelle d'un canal chlorure conservé au cours de l'évolution et largement exprimé pour établir un cadre moléculaire et comprendre la conduction du chlorure et le déclenchement des canaux.
Structure de sous-unité et assemblage de canaux. (A) Structure d'une seule sous-unité, montrant le domaine transmembranaire (rouge), domaine β interne (bleu), domaine β externe (orange), et HTH (vert). Les éléments de structure secondaires sont indiqués. (B) Assemblage du canal trimérique. Deux des sous-unités sont représentées en représentation de surface. (C) Vue orthogonale comme en (B), du côté extracellulaire. Crédit: Avancées scientifiques , doi:10.1126/sciadv.abe5983 
Les chercheurs ont utilisé des constructions marquées par des protéines fluorescentes vertes pour identifier les candidats TMEM206 et ont sélectionné le poisson-globe TMEM206 en raison de leur identité de séquence partagée à 50 pour cent avec le canal chlorure humain. Deng et al. ensuite purifié la protéine TMEM206 de poisson-globe de type sauvage pleine longueur et l'a soumise à une analyse cryo-EM à une seule particule. A l'aide de cartes de reconstruction 3D, ils ont révélé une architecture de canaux trimériques avec des domaines transmembranaires et extramembranaires. Le TMEM206 formait un trimère symétrique, où chaque sous-unité contenait un domaine transmembranaire (TMD) avec deux hélices transmembranaires nommées TM1 et TM2 et un grand domaine extracellulaire (ECD) enrichi de domaines β avec des motifs supplémentaires organisés dans les couches supérieure et inférieure. En outre, des contacts étendus de chaînes latérales ont été impliqués par le biais d'interactions de van der Waals dans les domaines β interne et externe. L'ensemble de canaux trimériques a introduit trois ouvertures latérales ou portails latéraux au milieu de la région extracellulaire pour probablement faciliter le passage des ions et de l'eau. Les portails latéraux allongés s'étendaient jusqu'à la jonction ECD-TMD pour que les interactions d'emballage serré reprennent. Pour surmonter toute difficulté technique de détermination de la structure de la protéine, Deng et al. fusionné l'extrémité C-terminale de la protéine de type transmembranaire induite par l'interféron à restriction osseuse (en abrégé BRIL); une protéine de faisceau à quatre hélices largement utilisée comme chaperon de cristallisation pour améliorer la stabilité de la membrane et favoriser la formation de cristaux.
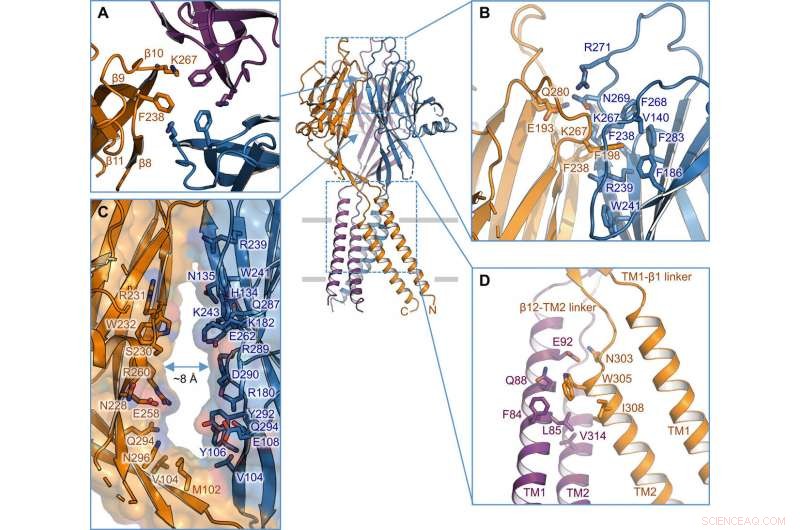
Interface intersous-unités. (A) Interface trimérique au sommet du DPE. Les chaînes latérales de K267 et F238 sont mises en évidence. (B) Vue latérale de l'interface intersous-unité au niveau de la couche supérieure de l'ECD. Les résidus impliqués dans l'interface sont représentés sous forme de bâton. (C) Portail latéral au milieu du DPE entre deux sous-unités voisines. La surface et les résidus tapissant le mur sont illustrés. (D) Interface intersous-unité TM1-TM2. Crédit: Avancées scientifiques , doi:10.1126/sciadv.abe5983
Études sur la voie de perméation ionique et la mutagenèse
En utilisant des calculs de rayon de pore, Deng et al. a montré comment le pore central de conduction ionique contenait de multiples constrictions pour empêcher le passage des ions. La structure représentait une conformation non conductrice en raison des conditions de tampon à pH élevé (pH 8,0) utilisées pour déterminer la structure cryo-EM. Le vestibule central volumineux et allongé pouvait être accédé latéralement en raison du manque de contacts protéine-protéine dans le domaine extracellulaire. Le point étroit du canal protéique n'interférait pas avec la conduction ionique et pouvait être maintenu pendant le cycle de déclenchement du canal lorsque les ions passaient à travers les trois portails latéraux. Le potentiel électrostatique légèrement positif des parois intérieures du vestibule central et des entrées latérales facilitait également l'attraction des ions chlorure. À la jonction domaine extracellulaire-domaine transmembranaire (ECD-TMD), trois brins connectés aux hélices externes et déplacés vers l'intérieur pour rejoindre les hélices internes pour générer une porte extracellulaire au-dessus de la couche bilipide. Des constructions consécutives aux positions faisant face aux pores formaient une grille hydrophobe qui pouvait interdire la conduction ionique.
Pour étayer les constatations structurelles, Deng et al. effectué des études de mutagenèse sur les principaux résidus vivant dans les pores. Lorsqu'ils ont substitué les résidus basiques conservés par des résidus alanine ou acides, les courants de chlorure activés par l'acide ont été supprimés. En revanche, les substitutions d'arginine ont conservé la fonction de canal pour soutenir davantage l'exigence de charges positives dans le filtre sélectif d'anions. Par exemple, le domaine I310 formait un composant critique de la grille transmembranaire et une autre structure connue sous le nom de K320 formait le filtre de sélectivité anionique. Le travail a soutenu la conservation structurelle entre les orthologues humain et poisson-globe pour représenter un modèle physiologiquement pertinent pour les canaux de chlorure.
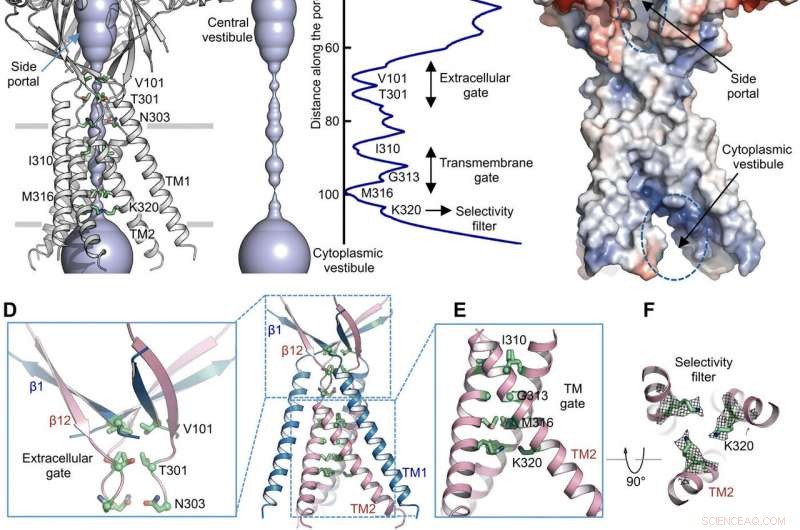
Voie de perméation ionique. (A) Structure de TMEM206EM et le pore central de conduction ionique, montré dans la représentation de surface. Les résidus générant des étranglements sont mis en évidence et étiquetés. Le portail latéral est indiqué. (B) Pore central de conduction ionique et estimation du rayon (panneau de droite). (C) Représentation surfacique du canal, coloré par le potentiel électrostatique de surface (rouge, -5 kT/e; blanche, neutre; bleu, +5 kT/e). La porte latérale et le vestibule cytoplasmique sont indiqués. (D) Porte extracellulaire à la jonction ECD-TMD. V101, T301, et N303 sont représentés en bâton. (E) Porte transmembranaire, constitué par I310, G313, et M316. (F) Filtre de sélectivité putatif défini par K320. Sont également indiquées les densités de chaînes latérales pour K320, profilé à 6,5 . (G et H) Densités de courant avec un pH extracellulaire de 7,3 (G) et 4,6 (H) à +100 mV pour les mutants TMEM206. Les courants membranaires de la cellule entière ont été enregistrés en utilisant une rampe de tension de -100 à +100 mV pendant 500 ms à un potentiel de maintien de 0 mV. (I) Rapport de densité de courant à pH 4,6 à pH 7,3. Crédit: Avancées scientifiques , doi:10.1126/sciadv.abe5983
Convergence structurelle
La topologie, la structure et l'assemblage de TMEM206 représentaient ceux de la superfamille des canaux sodiques épithéliaux (ENaC)/dégénérine des canaux ioniques, y compris les canaux ioniques à détection d'acide (ASIC); malgré un manque d'homologie de séquence d'acides aminés distincte entre les deux canaux. Les canaux trimériques pour les ions sodium et chlorure de charges opposées, partageaient néanmoins une structure centrale commune flanquée de deux hélices transmembranaires. L'équipe a noté comment la porte extracellulaire entre le vestibule central et le pore transmembranaire pouvait être élargie pour faire passer les ions après l'activation du canal. Alors que les canaux sodiques épithéliaux pourraient être activés en libérant des peptides inhibiteurs par protéolyse dans le domaine extracellulaire, les ASIC et TMEM206 ne pouvaient être activés que par des protons extracellulaires. Les caractéristiques structurelles conservées entre TMEM et AS1CS ont également suggéré des changements de conformation de déclenchement analogues pour les deux molécules.
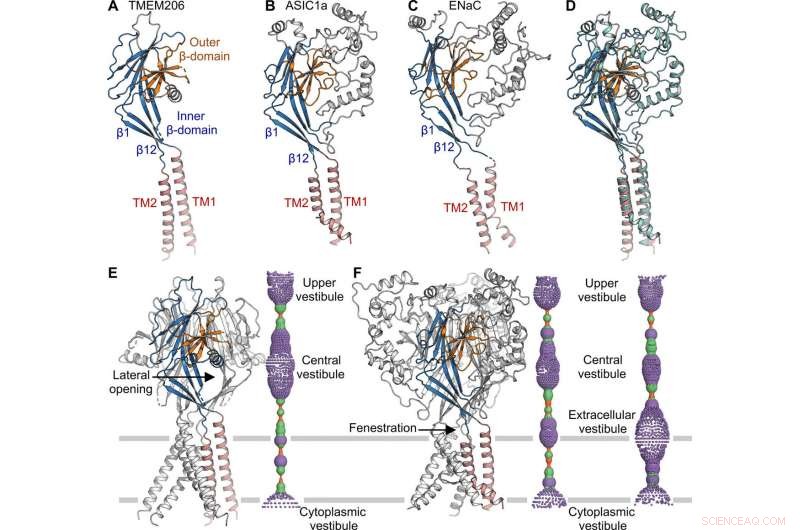
Comparaison structurelle avec ASIC et ENaC. (A à C) Structures de sous-unités de TMEM206 (A), ASIC1a [Banque de données sur les protéines (PDB) :6AVE] (B), et ENaC (APB :6BQN) (C). Les domaines sont de la même couleur. (D) Superposition de TMEM206, coloré comme en (A), et ASIC1a coloré en cyan. (E) Canal TMEM206 trimérique et son pore central de conduction ionique. Le pore est estimé à l'aide du programme HOLE et représenté par des points colorés (rayon du pore :rouge <1,15
Perspectives
De cette façon, Zengqin Deng et ses collègues ont utilisé la cryo-EM à particule unique pour déterminer la structure des protéines membranaires intégrales qui sont généralement inaccessibles à l'aide de la cristallographie aux rayons X traditionnelle. C'est toujours un défi technique important pour atteindre une résolution proche de l'atome pour les protéines membranaires de petite taille en raison du faible contraste et des rapports signal/bruit. Deng et al. ont obtenu une structure de résolution de 3,5 angströms d'un canal en fusionnant un petit chaperon de cristallisation BRIL pour améliorer la stabilité des protéines membranaires autrement sous-optimales afin de favoriser le tassement des cristaux. Sur la base de la structure de base conservée, les canaux étaient sélectifs pour les cations ou les anions et ont subi des changements de conformation de déclenchement similaires. Les travaux ont établi une nouvelle classe de canaux chlorure pour former un nouveau cadre pour d'autres investigations fonctionnelles et mécaniques en biologie cellulaire et structurelle.
© 2021 Réseau Science X