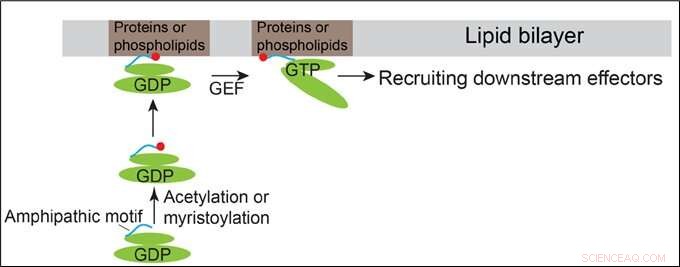
Modèle démontrant comment Arfrp1 et Arl14 sont recrutés dans les membranes. Crédit :HKUST
Les petites GTPases de la famille des facteurs ADP-ribosylation (Arf) sont des initiateurs clés de divers processus physiologiques, notamment la sécrétion, endocytose, phagocytose et transduction du signal. Les protéines de la famille Arf ont pour fonction de médier le recrutement d'effecteurs cytosoliques dans des compartiments subcellulaires spécifiques. Ce processus permet aux effecteurs Arf d'effectuer la reconnaissance de la cargaison, modification des lipides ou d'autres fonctions cellulaires.
Le blocage des activités des protéines de la famille Arf inhibe la sécrétion de molécules importantes de la cellule et inhibe également l'absorption cellulaire des nutriments. Les défauts des Arfs ou de leurs protéines régulatrices sont liés à diverses maladies héréditaires, dont la déficience intellectuelle liée à l'X (XLID), syndrome de Joubert, Syndrome de Bardet-Biedl et dysfonctionnement des cils. Ainsi, l'étude des mécanismes moléculaires des activités intracellulaires régulées par Arf représente une opportunité de comprendre l'étiologie de ces maladies et de développer de nouvelles stratégies thérapeutiques.
Les protéines de la famille Arf alternent entre un état inactif lié au GDP et un état actif lié au GTP. Ils ont des organisations structurelles similaires contenant un motif d'hélice amphipathique N-terminal et les domaines de commutation. Les domaines de commutation des protéines Arf se lient directement à leurs facteurs d'échange de nucléotides guanidine (GEF) correspondants, permettant ainsi aux protéines Arf de se lier au GTP. Il est généralement conçu que le recrutement membranaire des protéines Arf est initié par des changements de conformation induits par la liaison au GTP des protéines Arf.
En plus de ce mécanisme classique, Le professeur Guo et son équipe ont découvert que les motifs amphipathiques N-terminaux de la protéine de la famille Arf localisée dans le Golgi, Arfrp1, et la protéine de la famille Arf localisée dans l'endosome et la membrane plasmique, Arl14, sont suffisantes pour déterminer des localisations subcellulaires spécifiques d'une manière indépendante du GTP. L'échange des motifs d'hélice amphipathique entre ces deux protéines Arf provoque le basculement de leurs localisations. La détermination spatiale médiée par l'hélice Arfrp1 nécessite son partenaire de liaison Sys1. En outre, l'étude indique que l'acétylation de l'hélice Arfrp1 et la myristoylation de l'hélice Arl14 sont importantes pour la localisation subcellulaire spécifique. Un modèle proposé représente le recrutement membranaire d'Arfrp1 et Arl14.
Cette étude révèle de nouvelles informations sur la machinerie moléculaire qui régule l'association membranaire de certaines protéines Arf, suggérant que l'association membranaire et l'activation de certaines protéines Arf sont découplées. Cette étude propose également de nouveaux motifs courts pour cibler des protéines vers des localisations intracellulaires spécifiques.
Les résultats ont été récemment publiés dans la revue scientifique The Journal de chimie biologique .