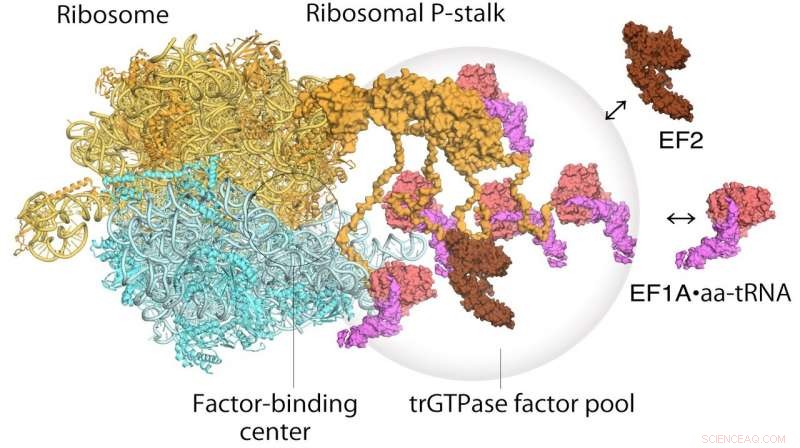
Modèle de traduction des ribosomes et des facteurs d'élongation. EF1A•GTP•aatRNA et EF2 s'assemblent à la tige ribosomique sur le ribosome de traduction. Le pool de facteurs de traduction contribue à une synthèse efficace des protéines dans un environnement intracellulaire surpeuplé. Crédit: Actes de l'Académie nationale des sciences
Les ribosomes sont les complexes de ribonucléoprotéines au cœur de la synthèse des protéines dans les cellules. Cependant, en l'absence de preuves concluantes, le fonctionnement de ces complexes a fait l'objet d'un débat. Maintenant, Hirotatsu Imai et Noriyuki Kodera à l'Université de Kanazawa, aux côtés de Toshio Uchiumi à l'université de Niigata au Japon, montrent des visualisations de la dynamique structurelle et de la mise en commun des facteurs qui ont lieu au niveau des protéines de la tige du ribosome au fur et à mesure qu'elles construisent de nouvelles protéines.
Les ribosomes ont été découverts pour la première fois dans les années 1950, et leur large fonction est largement comprise depuis un certain temps :ils lisent les séquences d'ARN messager, et de là, générer des séquences d'acides aminés correctement ordonnés en de nouvelles protéines. La protéine tige du ribosome en particulier joue un rôle intégral dans le processus de synthèse protéique en recrutant des facteurs protéiques responsables de la traduction et de l'allongement de la séquence d'acides aminés. Cependant, il a été difficile d'établir la structure de la protéine de tige de ribosome liée en raison de sa flexibilité. Ici, la haute résolution et la capture d'image rapide de la microscopie à force atomique à grande vitesse se sont avérées inestimables.
La microscopie à force atomique utilise une pointe nanométrique pour tracer les échantillons, un peu comme une aiguille de lecteur de disque vinyle balayant un disque, sauf que les détails identifiés par un microscope à force atomique peuvent avoir une résolution à l'échelle atomique. La polyvalence de la technique pour différentes surfaces était déjà un énorme avantage pour les études biologiques, mais avec l'avènement de la microscopie à force atomique à grande vitesse, la technique a pu capturer pour la première fois des processus dynamiques, également. Imaï, Uchiumi et Kodera ont utilisé la technique pour révéler que la protéine de tige bascule en fait entre deux conformations, une qui est en accord avec les modèles structurels précédents et une nouvelle conformation tout à fait inattendue.
Quant au fonctionnement du ribosome, un mécanisme en deux étapes avait déjà été proposé pour décrire comment l'information génétique est traduite par des protéines connues sous le nom de facteurs de traduction GTPase. La première étape est le recrutement des facteurs sur le site d'attache des facteurs sur la tige protéique, augmentant ainsi la concentration de facteurs là-bas, ce que l'on appelle la mise en commun des facteurs. La deuxième étape est la liaison et la stabilisation d'une GTPase traductionnelle sur le centre de liaison au facteur ribosomique pour catalyser l'hydrolyse de la GTPase. De leur étude de microscopie à force atomique à grande vitesse, les chercheurs ont pu obtenir la première preuve visuelle du mécanisme de mise en commun du facteur GTPase translationnel par la tige ribosomique.
Bien que l'étude n'ait pas été en mesure de fournir des preuves concluantes de l'action des facteurs une fois liés, les chercheurs ont noté que les facteurs semblaient être retenus à proximité une fois l'hydrolyse de la GTPase terminée, suggérant un rôle potentiel de la protéine de tige dans d'autres étapes de la synthèse des protéines. Les chercheurs concluent, "Les travaux futurs avec HS-AFM fourniront d'autres informations importantes pour comprendre les comportements dynamiques de ces machineries translationnelles complexes."