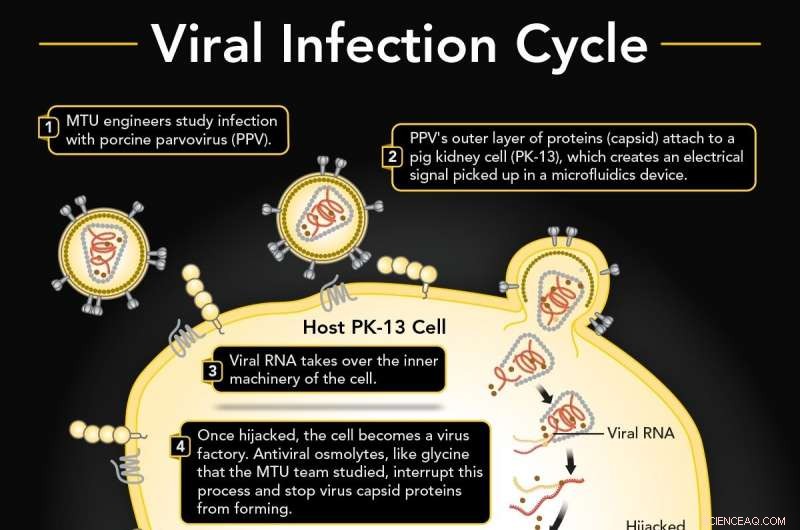
1. Le parvovirus porcin (PPV) infecte une cellule rénale de porc (PK-13). 2. Le PPV se fixe au PK-13 en utilisant sa couche externe de protéines (capside), qui peut être détecté dans un dispositif de microfluidique. 3. L'ARN viral détourne la machinerie interne de la cellule pour fabriquer plus de virus. 4. L'osmolyte antiviral glycine interrompt probablement la formation de capside. 5. Si ininterrompu, les répliques virales éclatent à travers la membrane cellulaire. 6. Il y a un décalage dans le signal électrique si la glycine est présente qui est différente d'une cellule infectée ordinaire. Crédit :Université technologique du Michigan
Un virus s'attache à une cellule, crochete la serrure et entre, prend ensuite le contrôle de la production génétique et pompe de nombreuses versions de lui-même qui explosent à travers la paroi cellulaire.
Obtenez votre pop-corn. Les ingénieurs et les virologues ont une nouvelle façon de surveiller la diminution des infections virales.
La technique utilise la microfluidique - le contrôle submillimétrique des fluides dans un structure géométrique. Sur ce qui est essentiellement une lame de microscope truquée, des ingénieurs chimistes de la Michigan Technological University ont pu manipuler des virus dans un dispositif microfluidique à l'aide de champs électriques. L'étude, publié cet été dans Langmuir , examine les changements dans la membrane cellulaire et donne aux chercheurs une idée plus claire de la façon dont les antiviraux agissent dans une cellule pour arrêter la propagation de l'infection.
L'infection virale commence par la capside
Les virus transportent une enveloppe externe de protéines appelée capside. Les protéines agissent comme un crochet, en s'attachant à la membrane d'une cellule et en la soulevant. Le virus détourne alors le fonctionnement interne de la cellule, le forçant à produire en masse le matériel génétique du virus et à en construire de nombreux, de nombreuses répliques virales. Tout comme les grains de maïs soufflé repoussant le couvercle d'un pot trop rempli, les nouveaux virus explosent à travers la paroi cellulaire. Et le cycle continue avec plus de crochets de virus en liberté.
« Quand vous regardez les techniques traditionnelles – l'étiquetage fluorescent pour différentes étapes, imagerie, vérifier la viabilité - il s'agit de savoir quand la membrane est compromise, " dit Adrienne Minerick, co-auteur de l'étude, doyen du College of Computing et professeur de génie chimique. "Le problème est que ces techniques sont une mesure indirecte. Nos outils regardent la répartition des charges, il est donc fortement concentré sur ce qui se passe entre la membrane cellulaire et la surface du virus. Nous avons découvert avec une plus grande résolution lorsque le virus pénètre réellement dans la cellule. »
Diélectrophorèse :conversation chargée
L'observation du cycle de l'infection virale et le suivi de ses étapes sont essentiels pour développer de nouveaux médicaments antiviraux et mieux comprendre comment un virus se propage. La diélectrophorèse se produit lorsque des cellules polarisables sont poussées dans un champ électrique non uniforme. Le mouvement de ces cellules est pratique pour diagnostiquer des maladies, groupe sanguin, l'étude du cancer et de nombreuses autres applications biomédicales. Appliqué à l'étude de l'infection virale, il est important de noter que les virus ont une charge de surface, donc dans l'espace confiné d'un dispositif microfluidique, la diélectrophorèse révèle la conversation électrique entre la capside du virus et les protéines d'une membrane cellulaire.
"Nous avons étudié l'interaction entre le virus et la cellule en relation avec le temps à l'aide de dispositifs microfluidiques, " dit Sanaz Habibi, qui a dirigé l'étude en tant qu'étudiant au doctorat en génie chimique à Michigan Tech. "Nous avons montré que nous pouvions voir des interactions virus-cellules dépendantes du temps dans le champ électrique."
Regarder une infection virale se produire en temps réel est comme un croisement entre un film d'horreur zombie, séchage de la peinture et une épopée Bollywood en répétition. Les cellules du dispositif microfluidique dansent, se déplaçant dans des motifs distincts avec un signal musical diélectrique. Il doit y avoir le bon ratio virus/cellules pour voir l'infection se produire, et cela ne se produit pas rapidement. L'expérience de Habibi se déroule en équipes de 10 heures, après les scènes d'ouverture de l'attachement viral, un long intermède d'intrusion, et finalement la finale tragique lorsque les nouveaux virus ont éclaté, détruire la cellule dans le processus.
Avant qu'ils n'éclatent, les membranes cellulaires forment des structures appelées bulles, qui modifient le signal électrique mesuré dans le dispositif microfluidique. Cela signifie que les mesures de diélectrophorèse permettent une compréhension à haute résolution des changements électriques qui se produisent à la surface de la cellule tout au long du cycle.
Entrez dans l'Osmolyte
Les infections virales sont une priorité en ce moment, mais tous les virus ne sont pas identiques. Alors que les dispositifs microfluidiques utilisant la diélectrophorèse pourraient un jour être utilisés sur site, des tests rapides pour les maladies virales comme COVID-19, l'équipe de Michigan Tech s'est concentrée sur un virus bien connu et étroitement étudié, le parvovirus porcin (PPV), qui infecte les cellules rénales du porc.
Mais ensuite, l'équipe a voulu repousser les limites :ils ont ajouté l'osmolyte glycine, une intervention importante que leurs collaborateurs étudient dans la chimie de la surface virale et le développement de vaccins.
"En utilisant notre système, nous pourrions montrer un comportement dépendant du temps du virus et de la membrane cellulaire. Ensuite, nous avons ajouté l'osmolyte, qui peut agir comme un composé antiviral, " expliqua Habibi. " Nous pensions que cela arrêterait l'interaction. Au lieu, il semblait que l'interaction se poursuivait au début, mais alors les nouveaux virus ne pouvaient pas sortir de la cellule."
C'est parce que la glycine interrompt probablement la nouvelle formation de capside pour les virus répliqués dans la cellule elle-même. Alors que cette partie spécifique de la danse virale se déroule derrière le rideau de la paroi cellulaire, les mesures diélectriques montrent un décalage entre un cycle infecté où la formation de capside se produit et une cellule infectée où la formation de capside est interrompue par la glycine. Cette différence de charge électrique indique que la glycine empêche les nouveaux virus de former des capsides et empêche les potentiels crocheteurs viraux d'atteindre leurs cibles.
"Lorsque vous travaillez avec de si petites particules et organismes, lorsque vous pouvez voir ce processus se dérouler en temps réel, c'est gratifiant de suivre ces changements, ", a déclaré Habibi.
Cette nouvelle vision des interactions entre les capsides virales et les membranes cellulaires pourrait accélérer les tests et la caractérisation des virus, en supprimant les technologies d'imagerie coûteuses et chronophages. Peut-être dans une future pandémie, il y aura un point de service, appareils portables pour diagnostiquer les infections virales et nous pouvons espérer que les laboratoires médicaux seront équipés d'autres appareils microfluidiques capables de dépister et de révéler rapidement les médicaments antiviraux les plus efficaces.