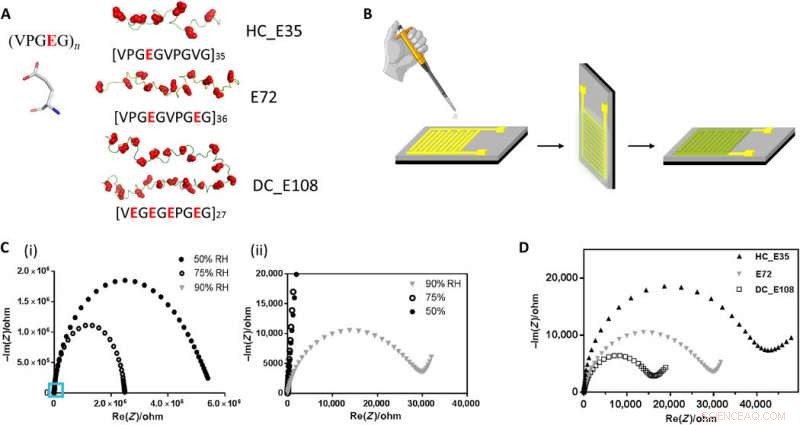
Structure du SUP anionique, dispositifs pour les mesures de conductivité protonique et les performances des différents SUP dans ces dispositifs. (A) Structure primaire des SUP conçues avec différentes densités de charge. (B) Protocole de fabrication de films protéiques déposés sur des IDE d'or. (C) Mesure d'impédance de l'échantillon E72 sous la forme d'un tracé de Nyquist sous différentes HR. La figure (ii) est la zone de zoom avant de (i) indiquée par le carré bleu. (D) Graphique de Nyquist de films minces de protéines à partir d'échantillons E72, HC_E35, et DC_E108 équilibré à HR =90 %. L'interception extrapolée du demi-cercle observé avec l'axe des x indique la résistance de l'échantillon dont l'échelle est HC_E35> E72> DC_E108. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc0810
Les protons sont des particules subatomiques avec une charge électrique positive. La translocation de protons joue un rôle important dans les phénomènes naturels et les technologies artificielles. Mais il reste difficile de contrôler la conduction et la fabrication des protons dans les biomatériaux et les dispositifs. Dans un nouveau rapport, Chao Ma et une équipe interdisciplinaire de scientifiques en Chine, les Pays-Bas, et l'Allemagne, matériaux constitutifs protéiques conducteurs de protons de conception rationnelle qui dépassaient les systèmes protéiques précédemment rapportés (constitués ou contenant des protéines). Ils ont développé les structures par l'exploration par étapes de séquences peptidiques allant de bobines intrinsèquement désordonnées à des chimères polypeptidiques suralimentées en protéines. Le nouveau paradigme de conception offre un potentiel pour la fabrication de dispositifs bioprotoniques aux interfaces des systèmes artificiels et biologiques, les résultats sont publiés sur Avancées scientifiques .
La conduction protonique est responsable de processus fondamentaux en biologie, y compris la bioluminescence, la synthèse d'adénosine 5'-triphosphate (ATP) et la translocation de protons déclenchée par la lumière. Les bio-ingénieurs et les scientifiques des matériaux avaient précédemment développé plusieurs matériaux synthétiques avec un comportement de translocation de protons, y compris des systèmes hybrides, bien que leurs lacunes aient entravé les domaines de la bioélectronique et de la biotechnologie. Développer des biomatériaux dédiés à la conduction protonique, les scientifiques doivent explorer des échafaudages et des séquences pour leur comportement intrinsèque conducteur de protons. Pendant les états hydratés, les protons peuvent être transportés via des molécules d'eau le long d'un réseau de liaisons adjacent dans un mécanisme connu sous le nom de saut de protons, qui est utilisé comme modèle pour concevoir des structures conductrices de protons de novo (c'est-à-dire à partir de zéro). Dans ce travail, Ma et al. développé une étape par étape, membrane conductrice de protons à base de protéines avec un ensemble de des polypeptides suralimentés anioniques (SUP) contenant des résidus d'acide glutamique.
Films de protéines sur substrats et caractérisation par SEM et AFM. (A) Procédure schématique pour la préparation de films polypeptidiques et protéiques conducteurs de protons par la technique de coulée en gouttes utilisée dans cette étude. (B) Images de microscopie électronique à balayage (MEB) montrant la morphologie plate et homogène de notre film mince personnalisé (ici E72 est montré à titre d'exemple) sur les électrodes. Le bord dentelé sur le côté gauche de a) est la position de troncature pour l'imagerie en coupe transversale en b). (C) Image AFM d'une surface de film mince rayé (en haut) et son profil de hauteur correspondant (en bas). L'échantillon E72 est montré ici à titre d'exemple. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc0810 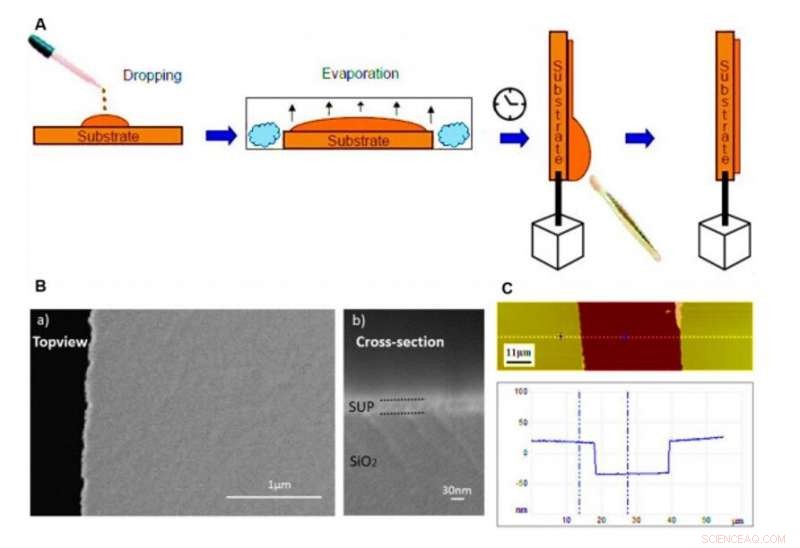
Dans le squelette polypeptidique de la membrane conductrice de protons, les fragments chargés hydrophiles (qui aiment l'eau) servaient de porteurs de protons. L'équipe a étudié les performances de conduction protonique de ces systèmes dépliés pour obtenir des membranes autoportantes et a perfectionné la conception structurelle en amalgamant des structures en feuille β ressemblant à de la soie avec des SUP anioniques pour former des nanostructures auto-assemblées. L'équipe a décoré les surfaces avec des groupes d'acide carboxylique denses pour l'hydratation, dissociation des protons et pour former des voies de conduction des protons. La membrane mécaniquement stable et autoportante a dépassé les propriétés de transport signalées jusqu'à présent des systèmes à base de protéines pour une conductivité protonique exceptionnelle.
L'équipe a dérivé les protéines suralimentées de l'élastine; exploré précédemment pour les applications de l'ingénierie des protéines et de la modification d'interface. Ils ont introduit l'acide glutamique (en abrégé Glu ou E), qui peut être facilement déprotoné dans des conditions physiologiques dans le site X de la séquence protéique, pour former des polypeptides surchargés négativement (SUP-E) non structurés. Ensuite, ils ont construit trois variantes différentes de polypeptides suralimentés appelés E72, HC_E35 et DC_E108. Ma et al. utilisé la spectroscopie d'impédance électrochimique (EIS) avec des électrodes interdigitées en or (IDE) pour évaluer la conduction des protons en couche mince et mesurer le transport des protons en fonction de l'humidité relative. Lorsque l'humidité a augmenté à 90 pour cent, la translocation des protons s'est améliorée grâce à l'absorption d'un grand nombre de molécules d'eau via les groupes acide carboxylique (-COOH) du matériau. Outre l'humidité relative, ils ont également étudié la conduction des protons par rapport à la densité des porteurs de charge pour les spécimens d'intérêt. En ajustant la densité de charge des protéines désordonnées, Ma et al. contrôle avec succès le comportement de conductance protonique des protéines dans les films. En raison de la grande stabilité et de l'uniformité des films minces en SUP, la configuration n'a pas montré de signes de défauts.
-30GFP suralimenté composé d'un pli nanoscopique en tonneau pour la conduction protonique. (A) Structure 3D de -30GFP suralimenté avec un excès d'acides glutamique/aspartique (en rouge) à la surface de la protéine. Le dessin de gauche visualise la structure en mode surface, montrant les résidus positifs en bleu et les négatifs en rouge. Le dessin animé de droite visualise le -30GFP sous la forme d'un diagramme en ruban présentant exclusivement des charges négatives. (B) Mesure de l'impédance de l'échantillon -30GFP (points solides jaunâtres) dans le tracé de Nyquist à 90 % HR, par rapport à d'autres échantillons SUP. (C) Comparaison de conductance entre les échantillons E72, HC_E35, DC_E108, et -30GFP (**P =0,004, n> 3). (D) Modèles GIXD pour l'étude de la structure des différents films. Deux signaux distincts ont été observés pour le -30GFP nanostructuré (à gauche), alors qu'aucun signal n'a été détecté pour les films E72 (à droite), indiquant sa nature non structurée. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc0810 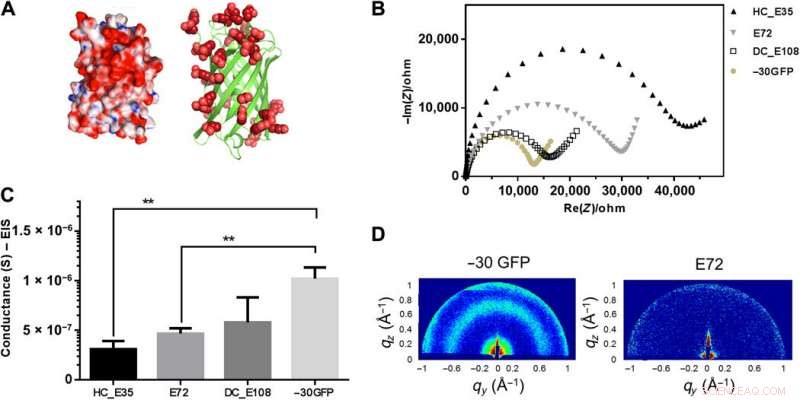
Ma et al. puis étudié plus avant les squelettes de protéines nanométriques repliés et équipé les échafaudages nanométriques avec de l'acide carboxylique à la surface, similaire aux SUP. En utilisant la diffraction des rayons X, ils ont étudié les informations structurelles à l'intérieur des échantillons de protéines suralimentées pour obtenir des signatures distinctes de leurs domaines structurels, montrer comment des composants nanostructurés pourraient faciliter la translocation de protons. Le travail a permis à l'équipe de concevoir rationnellement des motifs protéiques pour effectuer la conduction des protons. Motivé par une conductivité protonique accrue, Ma et al. combiné les éléments de conception résultants avec les structures polypeptidiques suralimentées (SUP) existantes.
Au lieu d'utiliser des motifs -baril dans l'architecture des matériaux, ils ont utilisé les structures de feuille β mécaniquement stables, une séquence obtenue à partir de la soie d'araignée. Ils ont nommé le système combiné de SUP anionique avec des séquences de feuillets comme « araignée-E ». The scientists produced the recombinant anionic spider-E material using plasmid-vector expression systems in the lab and determined the structure using X-ray diffraction, Fourier transform infrared (FTIR) spectroscopy and atomic force microscopy. The spider-E film showed higher proton conductance compared to amorphous SUP films alone.
Sequence, structure, and proton conduction of recombinant supercharged spider-E thin films on IDE. (A) Rationally designed supercharged spider silk–inspired proteins (spider-E). The spider motif contains a poly-A sequence (green) and anionic supercharged regions (red) that are forming the loops between the rigid β sheets. (B) Structure analyses of the spider-E supported film. Two peaks were detected by GIXD, indicating the characteristic intersheet and interstrand distances, respectivement. (C) FTIR characterization of the films indicate random coils for the E72 sample (gray dashed line) with an amide I peak located at 1640 cm−1 and a shift to a typical β sheet amide I peak for the spider-E sample (red solid line) at 1620 cm−1. (D) Morphology analyses of the spider-E supported film. Quantification of the nanostructures assembled through spider β sheet domains by AFM. This sample was obtained by extensive swelling of the film by water contact to induce separation between the domains. (E) Nyquist plots obtained at RH =90% for the five genetically engineered samples including spider-E. The impedance curve of the spider-E sample shows the lower resistance value among all the samples (red). (F) Comparison of conductance of the resulting devices demonstrating the stepwise increase in the transport properties due to the improved protein design. The proton transport of spider-E thin films on IDEs is noticeably higher than HC_E35 (***P =0.0009, n> 3) and DC_E108 (*P =0.0155, n> 3). Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc0810 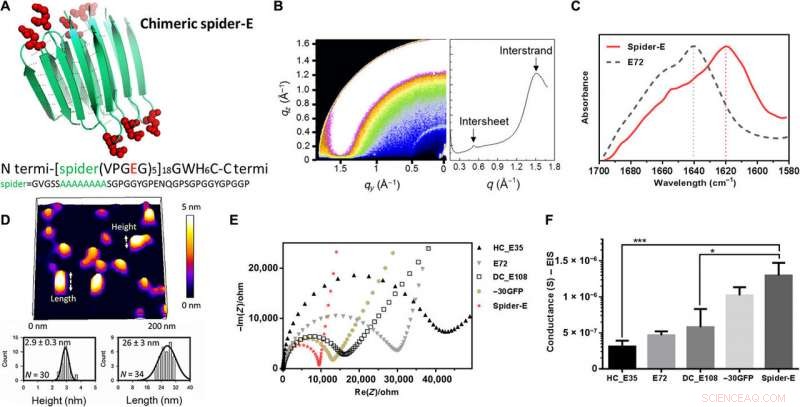
The β-sheet structured material system showed improved mechanical properties as a free-standing membrane that could be easily produced. Par exemple, Ma et al. drop casted the spider-E solution to engineer a transparent macroscopic membrane in the lab. The results showed mechanical robustness of the construct due to the inclusion of spider motifs with a yield strength comparable to recombinant spider silk materials. The researchers showed how spider motifs formed β-sheet structured domains with hydrophilic surfaces composed of glutamic acid-rich SUP strands, to facilitate excellent proton hopping. The study pushed the limits of existing proteinaceous proton-conducting materials to represent a key example of protein engineering. The work represents one of the first examples that combines protein engineering and the rational design of bulk architecture with collective properties from molecular ensembles.
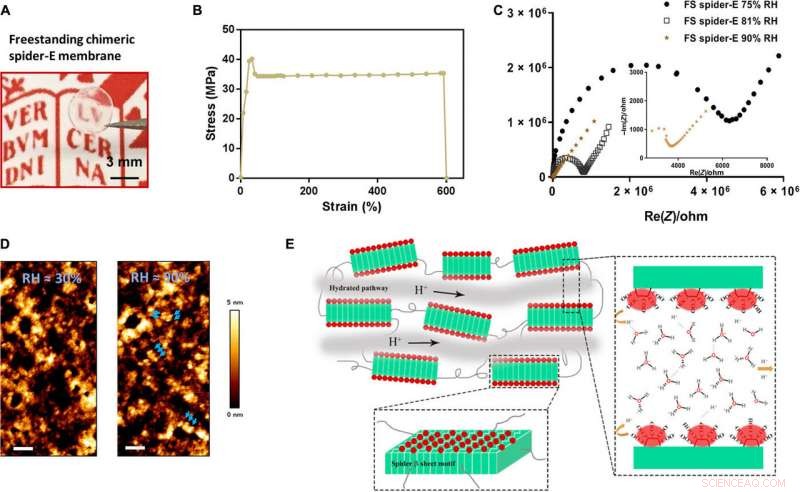
Bulk freestanding chimeric spider-E membrane with extraordinary proton transfer properties. (A) A digital photograph illustrates the dimensions and transparency of the membrane. The protein membrane is clamped with a fine tweezer. Photo credit:Chao Ma, University of Groningen. (B) Mechanical characterization of the freestanding (FS) protein membrane, showing a typical tensile stretching curve. (C) Nyquist plot illustrating the conductance behavior of the FS spider-E membrane under different RHs. The film shows best proton translocation properties at 90% RH. (D) AFM characterization of the FS spider-E membrane under ~30 and ~90% RH conditions. Barres d'échelle, 100 nm. Blue arrows point at distinguishable nanostructures. (E) Proposed mechanism of proton transport in the spider-E membrane at RH =90%. The protons hop between water molecules nanoconfined in the hydrated network of nanodomains formed by spider β sheet motifs (in green). The glutamic acid residues in the chimeric nanostructures present carboxylic groups (in red) on the surface, providing the protons and coordinating water molecules. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abc0810
De cette façon, Chao Ma and colleagues applied rational molecular de novo design and engineering to achieve a bioinspired protein-derived bulk material with robust properties of proton conduction and excellent mechanical stability. They tested the surface modifications using a range of biophysical tools. The team developed the new generation, bioinspired bulk material and explored successive sequence designs to offer a promising platform for applications in biotechnology and envision the use of such materials for proton transport in miniaturized biofuel cells of the future.
© 2020 Réseau Science X