
Une nouvelle étude de l'Université de Princeton et de l'Université Sapienza de Rome fournit des preuves solides d'une théorie controversée selon laquelle, à des températures très froides, l'eau peut exister sous deux formes liquides distinctes, l'un étant moins dense et plus structuré que l'autre. Crédit :Photo de John Salatas, Licence Creative Commons
L'eau, si ordinaire et si essentiel à la vie, agit d'une manière assez déroutante pour les scientifiques. Par exemple, pourquoi la glace est-elle moins dense que l'eau, flotter plutôt que de couler comme le font les autres liquides lorsqu'ils gèlent ?
Maintenant, une nouvelle étude fournit des preuves solides d'une théorie controversée selon laquelle à des températures très froides, l'eau peut exister sous deux formes liquides distinctes, l'un étant moins dense et plus structuré que l'autre.
Des chercheurs de l'Université de Princeton et de l'Université Sapienza de Rome ont effectué des simulations informatiques de molécules d'eau pour découvrir le point critique auquel une phase liquide se transforme en une autre. L'étude a été publiée cette semaine dans la revue Science .
"La présence du point critique fournit une explication très simple des bizarreries de l'eau, " a déclaré le doyen de la recherche de Princeton, Pablo Debenedetti, la classe de 1950 professeur en ingénierie et sciences appliquées, et professeur de génie chimique et biologique. "La découverte du point critique équivaut à trouver un bien, explication simple des nombreuses choses qui rendent l'eau étrange, surtout à basse température."
Les bizarreries de l'eau comprennent que lorsque l'eau se refroidit, il se dilate au lieu de se contracter, c'est pourquoi l'eau gelée est moins dense que l'eau liquide. L'eau devient également plus compressible ou compressible à des températures plus basses. Il existe également au moins 17 façons dont ses molécules peuvent s'arranger lorsqu'elles sont congelées.
Un point critique est une valeur unique de température et de pression à laquelle deux phases de la matière deviennent indiscernables, et cela se produit juste avant que la matière ne passe d'une phase à l'autre.
Les bizarreries de l'eau s'expliquent facilement par la présence d'un point critique, dit Debenedetti. La présence d'un point critique se fait sentir sur les propriétés de la substance assez loin du point critique lui-même. Au point critique, la compressibilité et d'autres mesures thermodynamiques du comportement des molécules, comme la capacité calorifique, sont infinis.
En utilisant deux méthodes de calcul différentes et deux modèles informatiques très réalistes de l'eau, l'équipe a identifié le point critique liquide-liquide comme se situant dans une plage d'environ 190 à 170 degrés Kelvin (environ -117 degrés à -153 degrés Fahrenheit) à environ 2, 000 fois la pression atmosphérique au niveau de la mer.
La détection du point critique est une étape satisfaisante pour les chercheurs impliqués dans la quête vieille de plusieurs décennies pour déterminer l'explication physique sous-jacente des propriétés inhabituelles de l'eau. Il y a plusieurs décennies, les physiciens ont émis l'hypothèse que le refroidissement de l'eau à des températures inférieures à son point de congélation tout en la maintenant sous forme liquide - un état "surfondu" qui se produit dans les nuages à haute altitude - exposerait les deux formes liquides uniques de l'eau à des pressions suffisamment élevées.
Pour tester la théorie, les chercheurs se sont tournés vers les simulations informatiques. Les expériences avec des molécules d'eau réelles n'ont pas jusqu'à présent fourni de preuve sans ambiguïté d'un point critique, en partie à cause de la tendance de l'eau en surfusion à geler rapidement en glace.
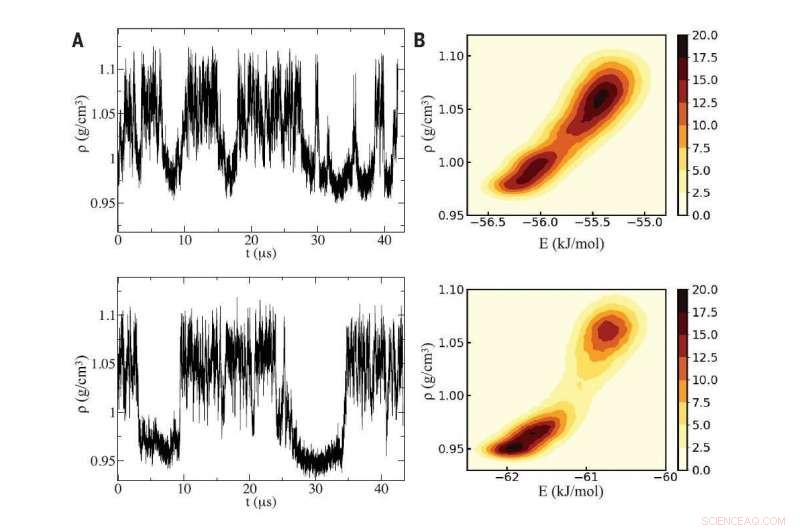
Fig A (gauche) :À l'aide de deux simulations informatiques distinctes de l'eau (panneaux supérieur et inférieur), les chercheurs ont détecté des variations de densité caractéristiques de l'eau surfondue oscillant entre deux phases liquides qui diffèrent par la densité. Fig B (à droite) :Les simulations ont révélé un point critique entre les deux phases liquides, dont les différentes densités trouvent leur origine au microscope dans l'intrusion d'une molécule d'eau supplémentaire dans l'environnement local d'une molécule centrale générique dans le liquide à haute densité. Crédit :Réimprimé avec la permission de PG Debenedetti et al, Science Vol 369 numéro 6501, DOI : 10.1126/science.abb9796
Francesco Sciortino, professeur de physique à l'Université La Sapienza de Rome, a mené l'une des premières études de modélisation de ce type alors qu'il était chercheur postdoctoral en 1992. Cette étude, publié dans la revue La nature , fut le premier à suggérer l'existence d'un point critique entre les deux formes liquides.
Le nouveau constat est extrêmement satisfaisant pour Sciortino, qui est également co-auteur de la nouvelle étude en Science . La nouvelle étude a utilisé des ordinateurs de recherche beaucoup plus rapides et plus puissants d'aujourd'hui et des modèles d'eau plus récents et plus précis. Même avec les puissants ordinateurs de recherche d'aujourd'hui, les simulations ont pris environ 1,5 an de temps de calcul.
"Vous pouvez imaginer la joie lorsque nous avons commencé à voir les fluctuations critiques se comporter exactement comme elles étaient censées le faire, " dit Sciortino. " Maintenant, je peux bien dormir, car après 25 ans, mon idée originale a été confirmée."
Dans le cas des deux formes liquides de l'eau, les deux phases coexistent dans un équilibre instable à des températures inférieures au point de congélation et à des pressions suffisamment élevées. Au fur et à mesure que la température baisse, les deux phases liquides s'engagent dans une lutte acharnée jusqu'à ce que l'une l'emporte et que tout le liquide devienne de faible densité.
Dans les simulations réalisées par la chercheuse postdoctorale Gül Zerze à Princeton et Sciortino à Rome, car ils ont fait baisser la température bien en dessous de zéro dans la plage de surfusion, la densité de l'eau a énormément fluctué comme prévu.
Certains des comportements étranges de l'eau sont probablement à l'origine des propriétés vitales de l'eau, dit Zerze. "Le fluide de la vie est l'eau, mais nous ne savons toujours pas exactement pourquoi l'eau n'est pas remplaçable par un autre liquide. Nous pensons que la raison a à voir avec le comportement anormal de l'eau. Les autres liquides ne montrent pas ces comportements, donc cela doit être lié à l'eau en tant que liquide de la vie."
Les deux phases de l'eau se produisent parce que la forme de la molécule d'eau peut conduire à deux façons de s'empiler. Dans le liquide de densité inférieure, quatre molécules se regroupent autour d'une cinquième molécule centrale dans une forme géométrique appelée tétraèdre. Dans le liquide de densité plus élevée, une sixième molécule se presse, ce qui a pour effet d'augmenter la densité locale.
L'équipe a détecté le point critique dans deux modèles informatiques différents de l'eau. Pour chaque modèle, les chercheurs ont soumis les molécules d'eau à deux approches informatiques différentes pour rechercher le point critique. Les deux approches ont abouti à la découverte d'un point critique.
Peter Poole, professeur de physique à l'Université St. Francis Xavier au Canada, et étudiant diplômé lorsqu'il a collaboré avec Sciortino et a co-écrit l'article de 1992 dans Nature, dit que le résultat était satisfaisant. "C'est très réconfortant d'avoir ce nouveau résultat, " Il a dit. " Cela a été une longue et parfois solitaire attente depuis 1992 pour voir un autre cas sans ambiguïté de transition de phase liquide-liquide dans un modèle d'eau réaliste. "
C. Austen Angell, Professeur Regents à l'Université d'État de l'Arizona, est l'un des pionniers des expérimentations dans les années 1970 sur la nature de l'eau surfondue. "Nul doute qu'il s'agit d'un effort héroïque dans la simulation de la physique de l'eau avec un très intéressant, et bienvenue, conclusion, " dit Angell, qui n'a pas participé à la présente étude, dans un e-mail. "En tant qu'expérimentateur ayant accès à des mesures physiques d'équilibre (à long terme) sur de l'eau réelle, Je m'étais toujours senti « à l'abri » de la préemption des simulateurs informatiques. Mais les données présentées dans le nouveau document montrent que ce n'est plus vrai."