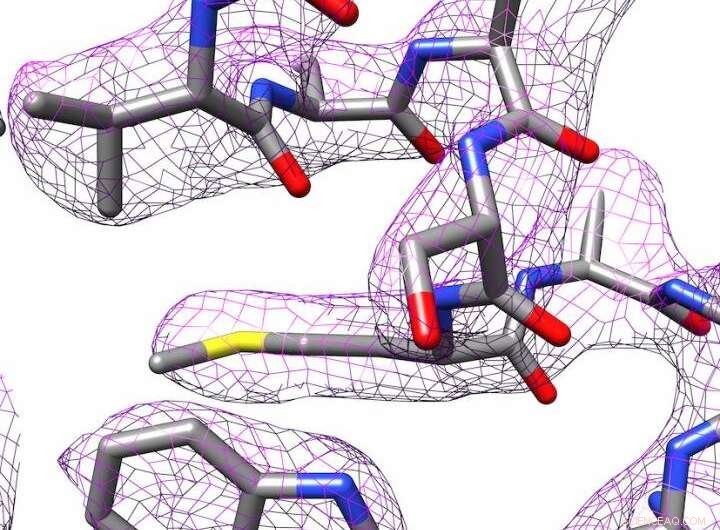
Structure 3D de l'apoferritine produite par cryo-microscopie électronique. Crédit :Panagiotis Kastritis
Les biochimistes de l'Université Martin Luther de Halle-Wittenberg (MLU) ont utilisé un cryomicroscope électronique standard pour obtenir des images étonnamment bonnes, comparables à celles prises par des équipements beaucoup plus sophistiqués. Ils ont réussi à déterminer la structure de la ferritine presque au niveau atomique. Leurs résultats ont été publiés dans la revue PLOS UN .
La cryo-microscopie électronique est devenue de plus en plus importante ces dernières années, en particulier pour faire la lumière sur les structures des protéines. Les développeurs de la nouvelle technologie ont reçu le prix Nobel de chimie en 2017. L'astuce :les échantillons sont surgelés puis bombardés d'électrons. Dans le cas de la microscopie électronique traditionnelle, toute l'eau est d'abord extraite de l'échantillon. Cela est nécessaire car l'enquête se déroule dans le vide, ce qui signifie que l'eau s'évaporerait immédiatement et rendrait l'imagerie impossible.
Cependant, parce que les molécules d'eau jouent un rôle si important dans les biomolécules, surtout dans les protéines, ils ne peuvent pas être examinés en microscopie électronique traditionnelle. Les protéines sont parmi les éléments constitutifs les plus importants des cellules et effectuent une variété de tâches. Une connaissance approfondie de leur structure est nécessaire pour comprendre leur fonctionnement.
Le groupe de recherche dirigé par le Dr Panagiotis Kastritis, qui est chef de groupe au Centre de compétences en innovation HALOmem et professeur junior à l'Institut de biochimie et de biotechnologie de MLU, a acquis un cryomicroscope électronique à la pointe de la technologie en 2019. « Il n'y a pas d'autre microscope comme celui-ci à Halle, " dit Kastritis. Le nouveau Thermo Fisher Glacios 200 kV, financé par le ministère fédéral de l'Éducation et de la Recherche, n'est pas le meilleur et le plus cher des microscopes du genre.
Néanmoins, Kastritis et ses collègues ont réussi à déterminer la structure de la protéine de stockage du fer apoferritine jusqu'à 2,7 ångströms (Å), en d'autres termes, presque jusqu'à l'atome individuel. Un ångström équivaut à un dixième de nanomètre. Cela place le groupe de recherche dans une ligue similaire aux départements dotés d'équipements beaucoup plus coûteux. L'apoferritine est souvent utilisée comme protéine de référence pour déterminer les niveaux de performance des microscopes correspondants.
Tout recemment, deux groupes de recherche ont battu un nouveau record avec une résolution d'environ 1,2 Å. « De telles valeurs ne peuvent être atteintes qu'à l'aide d'instruments très puissants, dont seule une poignée de groupes de recherche dans le monde ont à leur disposition. Notre méthode est conçue pour les microscopes trouvés dans de nombreux laboratoires, " explique Kastritis.
Les cryomicroscopes électroniques sont des appareils très complexes. "Même de petits désalignements peuvent rendre les images inutiles, " dit Kastritis. Il est important de les programmer correctement et Halle a l'expertise technique pour le faire. Mais l'analyse qui est menée après la collecte des données est tout aussi importante. " Le microscope produit plusieurs milliers d'images, " explique Kastritis.
Des programmes de traitement d'images sont utilisés pour créer une structure 3-D de la molécule. En coopération avec le professeur Milton T. Stubbs de l'Institut de biochimie et de biotechnologie de MLU, les chercheurs ont développé une nouvelle méthode pour créer un modèle à haute résolution d'une protéine. Le groupe de recherche de Stubbs utilise la cristallographie aux rayons X, une autre technique pour déterminer la structure des protéines, ce qui nécessite la cristallisation des protéines. Ils ont pu combiner une forme modifiée d'une technique d'analyse d'images avec les images prises avec le cryomicroscope électronique. Cela a rendu visibles les états de charge et les molécules d'eau individuelles.
"C'est une méthode attrayante, " dit Kastritis. Au lieu d'avoir besoin de microscopes très coûteux, beaucoup de capacité de calcul est nécessaire, dont MLU a. Maintenant, en plus d'utiliser la cristallographie aux rayons X, La cryomicroscopie électronique peut être utilisée pour produire des images de protéines, en particulier celles qui sont difficiles à cristalliser. Cela permet la collaboration, à l'intérieur comme à l'extérieur de l'université, sur l'analyse structurale d'échantillons à potentiel médical et biotechnologique.