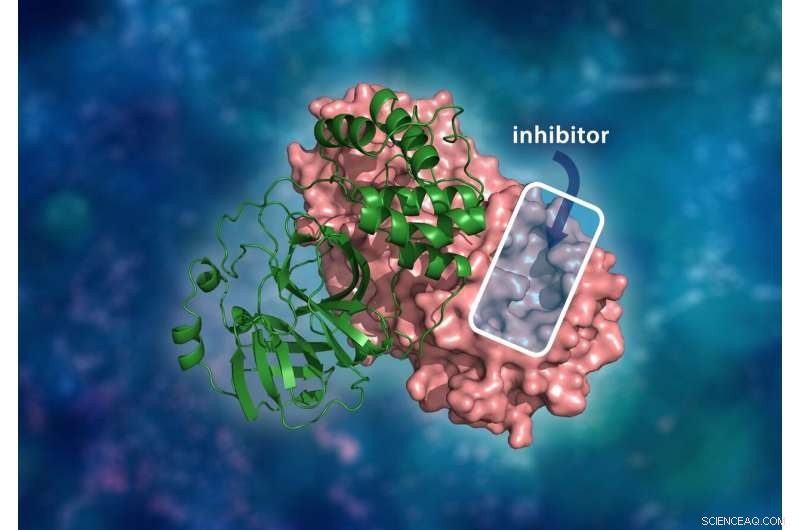
La structure tridimensionnelle de la protéase principale du SARS-CoV-2. Le complexe dimère moléculaire se compose d'un seul monomère (vert) lié à un autre monomère (rose) où un inhibiteur médicamenteux se lierait à une cavité du site catalytique pour empêcher le virus de se répliquer. Crédit :ORNL/Andrey Kovalevsky, Jill Hemman
Alors que le nouveau coronavirus continue de se propager, les chercheurs cherchent de nouvelles façons de l'arrêter. Mais pour deux scientifiques, regarder vers l'avenir, c'est s'inspirer du passé.
En janvier 2020, Andrey Kovalevsky et Daniel Kneller, chercheurs du laboratoire national d'Oak Ridge (ORNL) du ministère de l'Énergie (DOE), se préparaient à utiliser des neutrons pour étudier la relation entre une certaine protéase du VIH - une enzyme protéique qui permet au virus de se répliquer dans le corps humain - et une classe de médicaments antirétroviraux connus sous le nom d'inhibiteurs de la protéase du VIH. Certains types de VIH développent une résistance à ces médicaments. L'objectif des chercheurs était de mieux comprendre le fonctionnement des variations de la protéase, pour aider au développement de traitements de pointe pour vaincre même les souches résistantes du VIH les plus résistantes.
Lorsque l'équipe a commencé son travail, ils ne le savaient pas, par coïncidence, leurs efforts pour étudier le VIH les mettraient rapidement sur une nouvelle voie pour lutter contre le COVID-19, la pandémie qui a maintenant le monde sous son emprise.
Comme il s'avère, l'activité enzymatique de la protéase qui permet au VIH de se reproduire - le mécanisme même que l'équipe de Kovalevsky se préparait à étudier avec les neutrons - est le même mécanisme de réplication utilisé par le SARS-CoV-2, le virus qui cause la maladie COVID-19.
Maintenant, l'équipe a déplacé l'objectif de l'approche expérimentale qu'elle avait l'intention d'utiliser pour étudier le VIH afin de lutter contre la nouvelle menace mondiale.
Les études sur le VIH pivotent vers un nouveau coronavirus
Kovalevsky étudie le VIH depuis 15 ans. En tant que cristallographe neutronique, il étudie de petits échantillons cristallisés de matière biologique en les bombardant de neutrons. La technique de diffusion des neutrons est très efficace pour révéler comment la structure atomique d'un échantillon est arrangée et comment ses atomes se comportent. Selon l'objectif, les informations glanées peuvent offrir des conseils sur la façon d'améliorer ou même de supprimer certaines propriétés d'un matériau biologique.
Les neutrons sont un outil idéal pour étudier les structures et les comportements biologiques en raison de leur sensibilité aiguë aux éléments légers tels que l'hydrogène et de leur capacité à sonder ces matériaux sans les endommager.
En 2019, Kovalevsky a entrepris d'étudier le VIH d'une manière qui n'avait jamais été faite auparavant. L'utilisation de la diffusion inélastique des neutrons lui permettrait de collecter des données sur la dynamique, ou les mouvements, d'une protéase du VIH, ce qui s'ajouterait aux données de diffraction des neutrons qu'il avait recueillies pendant des années. Disposer à la fois des informations structurelles et comportementales - ou dynamiques - fournirait une image plus complète du fonctionnement du virus et, à son tour, pourrait conduire à de nouvelles avancées dans les traitements.
Après avoir utilisé le spectromètre VISION de la Spallation Neutron Source (SNS) de l'ORNL, un instrument de diffusion de neutrons qui révèle les mouvements des atomes en fonction de leurs vibrations, Kovalevsky s'est rendu compte qu'il avait besoin d'aide pour analyser les données.
"Daniel apporte son expertise dans la recherche sur les protéases virales, " a expliqué Kovalevsky à propos du recrutement de Kneller. " Il sait comment travailler avec les protéines en laboratoire. Il connaît toutes les techniques de laboratoire en matière de production de protéines, purification, cristallisation, collecte de données cristallographiques, et l'analyse pour obtenir des informations sur la conception de médicaments.
Il a fallu environ 8 mois pour embaucher Daniel après une recherche approfondie, dit Kovalevsky. Kneller, qui se spécialise dans l'étude de la protéase du VIH par cristallographie, a rejoint l'équipe de Kovalevsky en janvier 2020 pour aider aux travaux expérimentaux et informatiques sur la protéase du VIH.
Mais juste au moment où l'équipe était prête à plonger, COVID-19 était devenu mondial, et la recherche s'est arrêtée brutalement.

Le chercheur postdoctoral Daniel Kneller utilise le Centre de biologie structurale et moléculaire de l'ORNL pour synthétiser des protéines cristallisées liées à COVID-19 et les préparer pour des études de diffusion de neutrons à la source de neutrons de spallation et au réacteur isotopique à haut flux. Crédit :ORNL/Carlos Jones
Changement de vitesse, obtenir des résultats précoces
En mars, le personnel des sciences neutroniques de l'ORNL a élaboré un plan pour étudier les composants clés du COVID-19 en rassemblant des équipes de recherche et en redéfinissant les priorités de fonctionnement des instruments essentiels dans les deux installations de diffusion de neutrons de l'ORNL, SNS et le réacteur isotopique à haut flux (HFIR).
Ayant déjà jeté les bases pour étudier la protéase, Kovalevsky et Kneller sont rapidement passés du VIH au nouveau coronavirus. Spécifiquement, ils se concentrent actuellement sur la principale protéase du SARS-CoV-2, le virus qui cause la maladie COVID-19.
"La protéase SARS-CoV-2 est une enzyme qui coupe les protéines qui permettent au virus de se reproduire. Comprendre comment la protéase est assemblée et comment elle fonctionne est une première étape critique pour trouver des inhibiteurs médicamenteux efficaces pour bloquer le mécanisme de réplication du virus, " a déclaré Kovalevsky. " Similaire à la protéase du VIH, la principale protéase du virus SARS-CoV-2 est actuellement l'une des cibles médicamenteuses les plus attrayantes pour la conception d'inhibiteurs spécifiques. »
Comme pour le plan initial du travail sur le VIH, l'équipe se prépare à utiliser des instruments au SNS et au HFIR pour obtenir des informations fondamentales sur la façon dont les atomes de la protéase sont disposés. A l'aide des instruments MaNDi et IMAGINE, les chercheurs pourront reconstituer la structure atomique de la protéase en utilisant des neutrons pour suivre les atomes d'hydrogène dans les échantillons de protéines cristallisées.
Mais d'abord, ils doivent obtenir des cristaux de haute qualité suffisamment gros pour les expériences neutroniques. C'est là que l'équipe a fait des progrès significatifs dès le début.
La qualité du cristal est d'abord déterminée par la façon dont ils diffractent, ou se disperser, Rayons X. Typiquement, ce processus est conduit dans une installation synchrotron, où les cristaux peuvent être gelés à environ 100 K (ou environ -280°F).
L'équipe a utilisé le laboratoire de cristallisation et de caractérisation des protéines du SNS pour cultiver des cristaux de protéase SARS-CoV-2, qui a pris environ une semaine à 10 jours. Pour analyser la qualité des cristaux, ils ont utilisé la machine à rayons X locale, un HomeLab Rigaku HighFlux, qui a fourni plusieurs conclusions clés.
D'abord, les expériences aux rayons X ont confirmé que les cristaux étaient de haute qualité et que la méthode utilisée pour les faire croître pourrait produire des cristaux plus gros adaptés aux expériences neutroniques. Seconde, disposer d'une machine locale leur a permis de collecter des mesures radiographiques à température ambiante, environ 70°F.
Les mesures à température ambiante leur ont permis d'observer la plasticité, ou la flexibilité, de la structure de la protéase, fournissant des informations discernables sur le comportement de la structure dans des conditions proches de l'environnement physiologique du virus. Ces données n'ont pas pu être obtenues à partir d'échantillons congelés.
« C'est une étape importante dans nos efforts pour faire de la diffraction des neutrons. L'investissement dans une machine à rayons X locale a plutôt bien porté ses fruits, " a déclaré Kneller. " Dans un cas, nous avons fait pousser des cristaux lundi et collecté des données sur eux mardi. Autrement, pour obtenir cette information, vous devrez envoyer vos cristaux à un synchrotron, ce qui peut prendre des jours à des semaines."
"Et maintenant, à cause de la pandémie, tu ne peux pas aller dans un synchrotron, " ajouta Kovalevsky. " Et pour analyser les cristaux à température ambiante, il faut être là."
"Les informations que nous avons tirées de la structure à température ambiante ont la capacité d'avoir un impact immédiat sur les directions de calcul utilisées par les chercheurs. Nous avons trouvé des différences entre notre structure quasi physiologique à température ambiante et les structures gelées des synchrotrons, ce qui peut être important pour le travail de calcul, comme les études d'amarrage de petites molécules en cours sur le supercalculateur Summit de l'ORNL, " dit Kneller.

Vue microscopique des cristaux de protéase SARS-CoV-2 cultivés dans le laboratoire de cristallisation et de caractérisation des protéines de l'ORNL. Une fois que les cristaux atteignent une certaine taille et forme, ils seront utilisés dans des expériences de diffusion de neutrons pour déterminer comment la protéase principale du SRAS-CoV-2 est structurée et comment elle se comporte. Crédit :ORNL/Daniel Kneller
"Jusque là, nous avons eu beaucoup de succès dans nos premières études sur COVID-19. Nous avons déjà soumis un manuscrit pour publication sur nos découvertes structurelles, dans lequel nous avons essentiellement mené deux mois de recherche qui auraient normalement dû prendre un an. »
Leighton Coates a aidé Kovalevsky et Kneller dans l'analyse des données et de la structure des cristaux de protéines, un instrumentiste sur le diffractomètre SNS MaNDi qui est également membre de l'équipe cristallographique qui étudie la protéase SARS-CoV-2.
Les données générées au cours des prochains mois seront partagées avec d'autres laboratoires nationaux, les universités, et la communauté scientifique au sens large pour construire des modèles plus précis pour les simulations informatiques utilisées pour identifier les candidats-médicaments potentiels pour arrêter le virus.
« La communauté scientifique a réagi rapidement à la pandémie de COVID-19. Nous avons la chance de pouvoir apporter nos propres contributions en tirant parti d'années d'expérience dans l'étude du VIH pour mieux comprendre comment le nouveau coronavirus se réplique et comment nous pouvons le combattre en inhibant sa protéase essentielle, " a déclaré Kovalevski.
Recherche sur la résistance au VIH
Avant que la pandémie ne tourne leur attention et leurs efforts vers la recherche sur le SRAS-CoV-2, Kovalevsky et Kneller avaient un plan clair pour s'attaquer au VIH.
Trente-neuf millions de personnes dans le monde sont infectées par le VIH. Offrir à ces personnes de meilleures options de traitement améliorerait non seulement leur qualité de vie, mais empêcherait également cette maladie de se propager davantage.
La protéase du VIH agit en clivant inoffensif, ou non fonctionnel, brins de protéines en protéines plus petites, les transformer en protéines virales fonctionnelles qui permettent au virus de s'assembler et de continuer à infecter les cellules humaines saines. En général, Les inhibiteurs de la protéase du VIH sont assez efficaces pour bloquer la protéase pendant la réplication du VIH, mais certaines variantes de la protéase ont développé une capacité à résister aux inhibiteurs médicamenteux.
« Si nous pouvons en savoir plus sur les mécanismes moléculaires qui rendent les variants de la protéase du VIH résistants aux médicaments, nous pouvons concevoir des médicaments mieux équipés pour déjouer ses défenses, " dit Kneller.
Spécifiquement, Kneller et Kovalevsky voulaient explorer PRS-17, une variante unique de la protéase du VIH qui est 10, 000 fois moins susceptibles que d'autres variantes non résistantes d'être inhibées par les inhibiteurs cliniques de la protéase du VIH les plus efficaces actuellement disponibles. Kovalevsky a expliqué que si les programmes de traitement du VIH ont parcouru un long chemin depuis le début de la pandémie du VIH dans les années 1980, des variantes mutantes comme PRS-17, résultant d'un traitement prolongé, pourrait compromettre des années d'innovation et de progrès pharmaceutiques et entraîner l'échec des thérapies antivirales.
« La résistance aux médicaments est maintenant le plus gros problème pour les patients atteints du VIH. Avec un traitement approprié, les patients peuvent vivre longtemps et heureux avec des niveaux indétectables de VIH dans leur système. Ils ne développeront pas le SIDA et ne transmettront pas le VIH aux autres. Mais le PRS-17 et d'autres variantes de la protéase du VIH résistantes aux médicaments rendent difficile pour les médecins de lutter contre le VIH chez leurs patients, " a déclaré Kovalevsky.
Il est difficile de comprendre exactement comment le PRS-17 neutralise l'efficacité des inhibiteurs de la protéase du VIH, disent les chercheurs. Les protéines constitutives des virus sont des systèmes complexes, et PRS-17 a la capacité d'employer plusieurs mécanismes différents pour se prémunir contre les médicaments antirétroviraux.
« Découvrir comment le PRS-17 résiste aux inhibiteurs de la protéase du VIH est un défi, mais que nous devons absolument surmonter. PRS-17 est un isolat clinique, ce qui signifie qu'il est venu d'un patient réel luttant pour lutter contre cette maladie, " a expliqué Kneller. " En savoir plus à ce sujet pourrait sauver la vie de nombreux patients, parce que les connaissances que nous acquérons en utilisant les neutrons sur PRS-17 seront transférables à d'autres variantes de protéases extrêmement résistantes aux médicaments."
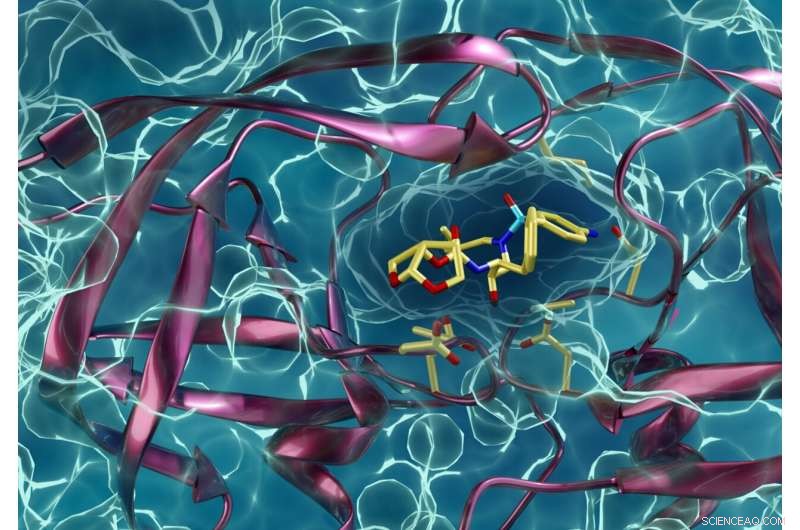
Type de protéase du VIH résistante aux médicaments interagissant avec un inhibiteur de la protéase du VIH. Kneller et Kovalevsky espèrent que les mêmes techniques qu'ils ont utilisées pour en savoir plus sur le VIH aideront également leurs collègues chercheurs à lutter contre le COVID-19. Crédit :ORNL/Jill Hemman
L'équipe avait l'intention de créer une carte de la protéase PRS-17 pour mieux comprendre les mécanismes moléculaires derrière sa résistance aux médicaments. Cela impliquait d'utiliser les instruments MaNDi et VISION à SNS et l'instrument IMAGINE à HFIR.
"C'était à peu près la même approche que nous essayons maintenant avec COVID-19, " a déclaré Kovalevsky.
Avec MaNDi et IMAGINE, Kneller et Kovalevsky prévoyaient de sonder des échantillons cristallisés de protéase PRS-17 pour générer des données détaillées sur sa structure atomique statique. L'utilisation de VISION leur permettrait de sonder des échantillons de poudre de protéase PRS-17 afin de mieux comprendre ses propriétés dynamiques en mesurant les vibrations moléculaires.
Les neutrons sont particulièrement bien adaptés pour étudier les composants de virus tels que le VIH (ou SARS-CoV-2) en raison de leur sensibilité à l'hydrogène, un composant important de toutes les protéines. Avec la cristallographie neutronique, l'équipe a pu localiser avec précision chaque atome d'hydrogène dans la protéase de PRS-17, leur donnant un aperçu sans précédent du fonctionnement de la protéine et des interactions qu'elle subit avec un inhibiteur de protéase.
"Utilisez la cristallographie neutronique à MaNDi et IMAGINEz pour localiser les atomes d'hydrogène dans les cristaux de la protéase PRS-17, nous permettrait de construire un profil complet de sa structure statique, " dit Kneller. " Avec VISION, nous suivrions également les atomes d'hydrogène, mais nous utiliserions des échantillons en poudre de protéase PRS-17 qui ont été réhydratés pour imiter les conditions de surpeuplement d'une particule virale du VIH. Cela nous permettrait de voir ses propriétés dynamiques et d'en savoir plus sur la façon dont il pourrait se déplacer lorsqu'il travaille au sein d'une particule virale."
Kneller a expliqué qu'il est important d'obtenir des informations sur les propriétés statiques et dynamiques du PRS-17 pour développer une compréhension complète de la résistance de ce virus aux médicaments antirétroviraux.
"Si je ne suivais votre position qu'une fois par jour à minuit, Je pense que tu passes tout ton temps à la maison. Mais réellement, vous vous déplacez pas mal tout au long de la journée. C'est pourquoi il est important de collecter à la fois des mesures statiques et dynamiques de notre échantillon. Cela nous permet de construire une image plus complète du comportement de la protéase, " dit Kneller.
"Sans cristallographie neutronique, les chercheurs doivent faire des suppositions éclairées sur l'emplacement des atomes d'hydrogène dans une protéine chaque fois qu'ils tentent de comprendre comment la protéine fait son travail, " a ajouté Kneller. " Ces types d'expériences qu'Andrey a réalisées précédemment ont en fait été en mesure de confirmer l'emplacement de ces atomes d'hydrogène dans des variantes de protéase du VIH non résistantes, mais jamais dans une variante de protéase extrêmement résistante aux médicaments. Cela signifie que nous serions en mesure de produire des données vraiment uniques et nouvelles sur cette protéase. »
Kneller et Kovalevsky espèrent un jour générer des données grâce à leurs expériences qui deviendront une ressource inestimable pour les chercheurs cherchant à lutter contre les souches de VIH résistantes aux médicaments.
"C'est un travail d'équipe. Chimistes, biologistes, et les professionnels de l'industrie pharmaceutique doivent travailler ensemble pour lutter contre la maladie, " dit Kneller. " Ensemble, nous pouvons développer des traitements efficaces pour les souches de VIH résistantes aux médicaments."
La recherche a été soutenue par le DOE Office of Science par le biais du National Virtual Biotechnology Laboratory, un consortium de laboratoires nationaux du DOE axé sur la réponse au COVID-19, avec un financement fourni par la loi Coronavirus CARES.