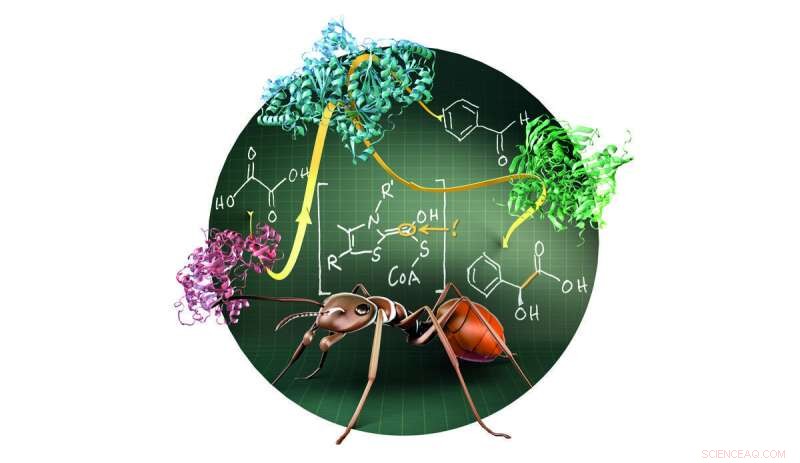
L'acide formique, le constituant principal du venin de fourmi, joue un rôle clé dans la synthèse enzymatique de l'acide mandéique. Une cascade à trois enzymes convertit les matières premières bon marché et sûres, l'acide oxalique et le benzaldéhyde dans des conditions douces en acide mandélique, un élément constitutif important pour la production chimique de cosmétiques, les saveurs, et drogues. Crédit :Institut Max Planck de Microbiologie terrestre/Burgener
Parfois, les enzymes potentiellement utiles ne sont pas faciles à découvrir car leurs capacités biocatalytiques peuvent aller au-delà de leur champ d'action naturel et donc connu. En recombinant une capacité enzymatique nouvellement découverte, une équipe de recherche de l'Institut Max Planck de microbiologie terrestre dirigée par Tobias Erb a créé une façon « verte » de produire de l'acide mandélique.
La synthèse chimique est très puissante, mais cela a un coût élevé :composés toxiques, dangers environnementaux, dépendance vis-à-vis des ressources non renouvelables. La synthèse chimique de l'acide mandélique ne fait pas exception. C'est un produit chimique fin important, utilisé dans les cosmétiques et comme bloc de construction pour les médicaments et les arômes, mais sa synthèse repose sur l'utilisation de cyanure, un poison puissant.
Microbes, en revanche, peut utiliser des enzymes et produire de manière durable des produits chimiques précieux à partir de substrats très bon marché, dans un processus appelé fermentation. L'humanité bénéficie de leur savoir-faire depuis des millénaires, de la fabrication du yaourt et du brassage de la bière dans les temps anciens à la production recombinante d'insuline aujourd'hui. Cependant, la plupart des micro-organismes présents dans la nature ne peuvent pas être cultivés en laboratoire ou ne produisent pas le composé souhaité. La biologie synthétique a donc un rôle clé à jouer dans l'exploitation du potentiel fermentaire au regard de la mise en œuvre de procédés « verts » dans l'industrie chimique.
Nouvelles combinaisons d'enzymes bien connues
Parfois, les enzymes potentiellement utiles ne sont pas faciles à reconnaître car leur capacité enzymatique dépasse leur fonction naturelle. Une équipe de recherche dirigée par Tobias Erb a maintenant trouvé une méthode pour la production verte d'acide mandélique. Il repose sur une activité nouvellement identifiée de l'enzyme oxalyl-CoA décarboxylase (OXC). Dans la nature, cette enzyme joue un rôle important dans la dégradation de l'oxalate de calcium, lequel, s'il s'accumule dans le corps, peut causer des problèmes de santé tels que des calculs rénaux. Ils ont découvert que l'enzyme dégrade non seulement l'oxalate, mais peut également créer une nouvelle liaison entre deux atomes de carbone.
Au cours de la réaction, L'OXC produit une forme très active d'acide formique, le principal constituant du venin de fourmi. OXC condense cet intermédiaire activé avec un aldéhyde, une autre molécule très réactive. Les scientifiques ont amélioré l'enzyme par des mutations chirurgicales et l'ont combiné avec deux autres enzymes. Ce faisant, ils ont créé une cascade en trois étapes qui convertit les matières premières bon marché et sûres, l'acide oxalique et le benzaldéhyde en acide mandélique dans des conditions douces. Par ailleurs, ils ont pu synthétiser une large gamme de dérivés de l'acide mandélique, qui peut être très utile dans la conception de nouveaux médicaments.
L'utilisation de biocatalyseurs en biologie synthétique
Jusque là, la méthode repose sur des enzymes purifiées. L'introduction des trois enzymes dans un système microbien ou synthétique pourrait éventuellement permettre un processus de fermentation écologiquement durable des acides mandéliques et de ses dérivés. Dans un contexte plus large, les résultats soulignent le vaste potentiel catalytique des enzymes et démontrent que des enzymes bien connues peuvent avoir de nouvelles, activités très utiles. En réalité, les fonctions enzymatiques que nous connaissons jusqu'à présent ne sont probablement que la pointe de l'iceberg. L'exploration du plein potentiel de ces biocatalyseurs polyvalents fera de la synthèse enzymatique une alternative toujours plus puissante à la synthèse chimique.