Crédit :CC0 Domaine public
Les scientifiques du NUS ont découvert un nouveau mécanisme de réduction électrochimique sélective du dioxyde de carbone (CO
Réduction électrochimique du CO
Une équipe de recherche dirigée par le professeur Yeo Boon Siang, Jason du département de chimie de NUS, en collaboration avec une équipe dirigée par le Dr Federico Calle-Vallejo de l'Université de Barcelone, a montré qu'un afflux de molécules de CO, fournis par des co-catalyseurs à l'argent (Ag), active une voie mécanique autrement verrouillée sur Cu qui convertit le CO
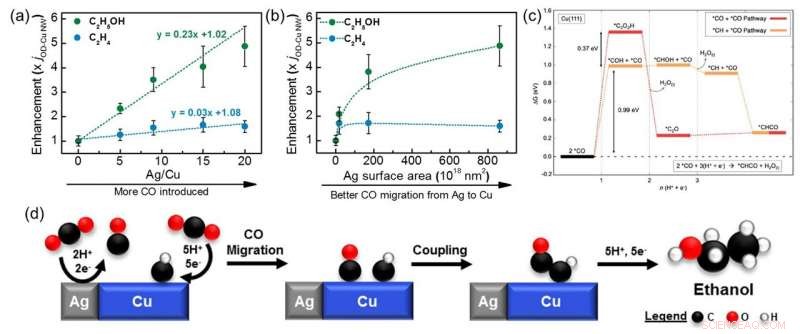
Graphiques montrant comment l'amélioration de la production d'éthanol (vert) et d'éthylène (bleu) sur des composites cuivre-argent (Cu-Ag) varie avec différents (a) rapports Ag/Cu et (b) tailles de particules d'Ag. Une amélioration de cinq fois a été observée pour l'éthanol, tandis que l'éthylène n'a pas été significativement impacté. (c) Diagramme de niveau d'énergie montrant les étapes de couplage CO+CO (rouge) et CO+CH (orange) sur Cu (111). Une barrière inférieure est requise pour le couplage CO+CH, la rendant plus favorable que l'étape CO+CO. (d) Schéma montrant le mécanisme de réduction du CO2 en éthanol sur des composites Cu-Ag via un couplage CO+CH. Crédit :ACS Catalyse
Une série de catalyseurs composites Cu-Ag, fabriqué à partir d'un mélange de nanofils de Cu dérivés d'oxyde et de poudres d'Ag, ont été testés pour leur CO électrochimique
D'autres plans découlant de cette découverte par l'équipe de recherche comprennent la maximisation des sites actifs grâce à la conception de catalyseurs et à une production à plus grande échelle en utilisant une configuration de cellule à écoulement à haut débit.
Le professeur Yeo a dit, "Le concept selon lequel une voie précédemment fermée peut être ouverte par un afflux d'intermédiaires, comme le montre ce travail, ouvre de nouvelles possibilités pour découvrir de nouveaux mécanismes synthétiques qui pourraient auparavant être inaccessibles."