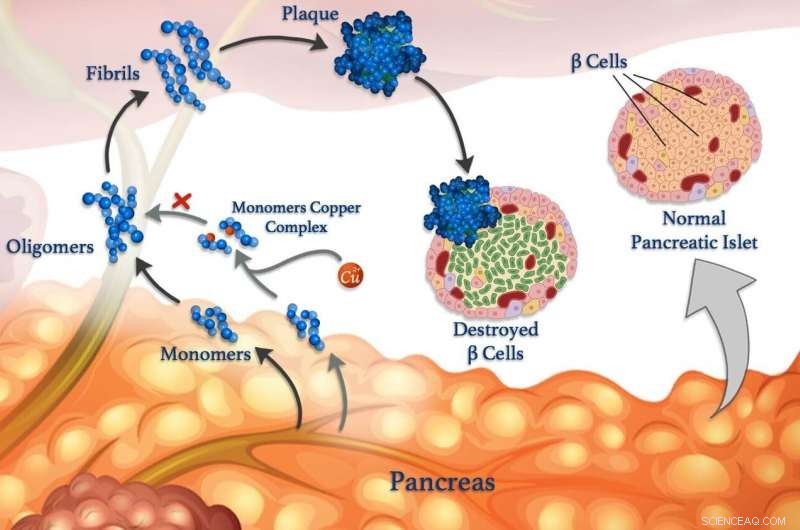
Les ions de cuivre (sphères rouges) peuvent se fixer aux monomères peptidiques (bleus) et les empêcher de s'agglutiner pour former des oligomères, fibrilles et plaques endommagées. © 2020 Mawadda Alghrably
Démêler les interactions entre les ions métalliques et les peptides dans le corps peut éventuellement conduire à de meilleurs traitements pour le diabète, Alzheimer et autres maladies. La compréhension de ces interactions est au cœur de la recherche, co-dirigé par KAUST, qui révèle comment les métaux, comme le cuivre, peut affecter la formation de touffes nocives d'amas peptidiques mal repliés appelés fibrilles, qui sous-tend de nombreuses maladies.
Les peptides errants sont liés à des troubles neurologiques tels que la maladie d'Alzheimer, ainsi que pour contrôler la glycémie, maladie du diabète. Les niveaux de sucre dans le sang sont normalement contrôlés par des hormones peptidiques libérées par des cellules spécialisées appelées cellules β. En plus de l'insuline, les cellules β saines libèrent également de l'amyline, une hormone peptidique qui aide à réduire les pics de glycémie après avoir mangé en ralentissant la vidange de l'estomac. Mais l'amyline a tendance à former des touffes mal repliées, surtout en présence d'ions cuivre, qui endommagent les cellules et contribuent au diabète de type II.
Cependant, les ions métalliques peuvent également contrecarrer l'agrégation peptidique dans certaines circonstances, dit le chercheur de KAUST, Mariusz Jaremko, qui a dirigé les travaux en collaboration avec des chercheurs de l'Université de Wroclaw en Pologne. Pour étudier plus en détail le processus, l'équipe examine l'interaction entre les ions cuivre(II) et l'amyline et ses analogues moléculaires. "Une telle connaissance nous donnerait un aperçu des mécanismes moléculaires du diabète de type II, nous permettant de concevoir de nouvelles stratégies et thérapies contre cette maladie, " dit Jaremko.
Dans leur dernier ouvrage, l'équipe a étudié l'influence des ions cuivre sur l'agrégation de deux analogues de l'amyline humaine :un médicament imitant l'amyline appelé pramlintide et l'amyline de rat. "Nous avons constaté que les différences dans les structures du pramlintide et de l'amyline de rat signifient que les ions de cuivre empêchent l'agrégation du pramlintide, mais pas l'amyline de rat, " dit Mawadda Alghrably, un doctorat étudiant dans l'équipe de Jaremko.
Les chercheurs ont étudié le processus à l'aide de plusieurs techniques, y compris la résonance magnétique nucléaire (en collaboration avec Abdul-Hamid Emwas de KAUST CoreLabs), et un essai de fluorescence « thioflavine T » de l'agrégation des protéines. Ils ont découvert que bien que les deux analogues de l'amyline se lient au cuivre, le pramlintide pourrait le lier de deux manières différentes en raison d'un acide aminé histidine supplémentaire de liaison au cuivre qui est présent dans le pramlintide mais pas dans l'amyline de rat. La liaison de l'ion cuivre à cette histidine a probablement expliqué pourquoi le cuivre réduisait l'agrégation du pramlintide mais pas l'agrégation de l'amyline de rat, concluent les chercheurs.
L'équipe continue de déchiffrer les bases moléculaires de l'agrégation de l'amyline, dit Alghrably. « Comprendre le comportement de ces molécules, pourrait à terme contribuer à faciliter la conception de nouveaux médicaments et thérapies efficaces pour le diabète de type II, " elle dit.