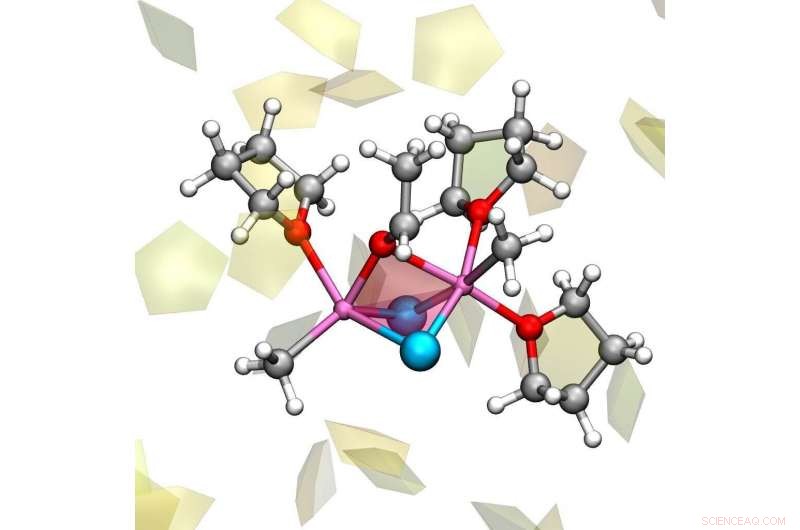
Le complexe réactif de la réaction de Grignard, impliquant deux molécules de réactif de Grignard CH3MgCl interagissant avec l'acétaldéhyde, et avec trois molécules d'éther de tétrahydrofurane. D'autres molécules de solvant sont dessinées sous forme de pentagones. Crédit :Michele Cascella
La réaction de Grignard permet de synthétiser des liaisons carbone-carbone, une étape cruciale pour fabriquer de nouvelles molécules à usage académique et industriel. Trouver des méthodes efficaces et sélectives pour cette réaction, l'utilisation de matériaux à faible coût et de ressources énergétiques minimales est la cible de l'activité de recherche depuis plus de 100 ans. Assez incroyablement, le fonctionnement de la réaction de Grignard était inconnu jusqu'à présent. Comme nous le comprenons enfin, les voies de son amélioration peuvent désormais s'ouvrir.
Vous n'avez pas besoin d'être chimiste pour connaître l'importance d'un échafaudage en carbone. En réalité, les molécules à base de carbone ne sont pas seulement les éléments constitutifs essentiels de tous les organismes vivants, y compris les acides nucléiques, graisses, protéines, enzymes, mais ils sont aussi des composants essentiels de la plupart des matériaux de la vie quotidienne, par exemple les carburants hydrocarbonés, plastiques, ou de la drogue. Si nous ne pouvions pas synthétiser les liaisons carbone-carbone, nos vies seraient très différentes. Imaginez ne pas être en mesure de fabriquer les médicaments nécessaires ou tout autre matériel léger à usage quotidien !
Tout a commencé il y a 120 ans avec la réaction de Grignard qui a permis pour la première fois la formation sur mesure de liaisons carbone-carbone. Cette réaction a été largement utilisée depuis lors, et bien étudié, mais jamais complètement compris.
Le prix Nobel de chimie, mais sans bonne explication
En 1900, Victor Grignard a découvert que le magnésium métallique se dissolvait dans l'éther en présence de bromoalcène. Le composé résultant, qui s'appelait alors le réactif de Grignard, réagi avec des types spécifiques de molécules (aldéhydes ou cétones) pour former de nouveaux produits, décrit comme provenant de la fusion des deux espèces initiales. Cette réaction, nommé plus tard la réaction de Grignard, a été publié en tant que communication dans les "Comptes Rendus Hebdomadaires de l'Académie des Sciences" et a été immédiatement un succès. En 1901, Grignard a obtenu le doctorat. titre de l'Université de Lyon, et onze ans après, à 41 ans, le prix Nobel de chimie.
Depuis, la réaction de Grignard est universellement reconnue, enseigné dans tous les cours de chimie de base et largement utilisé, et encore aujourd'hui, il façonne le monde de la chimie organique.
"Ne pas comprendre les bases moléculaires d'un processus aussi fondamental est très frustrant pour les chimistes. En fait, un tel manque de connaissances empêche les scientifiques de développer des moyens d'optimiser le processus, " dit le professeur Odile Eisenstein, l'un des scientifiques à l'origine de l'étude.
Poser la bonne question, aux bonnes personnes, au bon moment
Il y a cinq ans, Le professeur Odile Eisenstein a donné un séminaire à l'Université d'Oslo. Poussé par une question sur la complexité en chimie du professeur Mats Tilset, elle a présenté la réaction de Grignard comme un exemple prototype d'un système trop complexe pour être compris. Cette déclaration a stimulé la curiosité du professeur Michele Cascella qui était assis dans l'auditoire, et qui a décidé de regarder de plus près. Une collaboration est née.
"Je suppose que le nom de la réaction de Grignard sonne une cloche dans l'esprit de tout chimiste. C'est probablement la première réaction chimique organique que j'ai apprise, en tant qu'étudiant, " dit Cascella.
Méthodes informatiques pour zoomer sur la chimie expérimentale
Même si la composition chimique du réactif de Grignard est connue, il n'a pas été possible de déterminer sa structure tridimensionnelle. En réalité, les expériences indiquent qu'il existe de nombreuses structures qui se transforment continuellement les unes dans les autres, un processus qui prend le nom d'« équilibre de Schlenk ». La situation est encore compliquée par la preuve que cet équilibre est influencé par les différents groupes liés à l'atome de magnésium central, et par le solvant.
Eisenstein et Cascella ont décidé d'aborder le problème en utilisant des simulations informatiques. Modéliser à la fois le réactif et le solvant de manière réaliste, ils ont pu détecter les multiples espèces chimiques pendant l'équilibre de Schlenk. Surtout, leur étude a identifié que l'ensemble du processus est déterminé par des molécules de solvant qui se combinent pour, ou se détacher de, les atomes de magnésium. Ainsi, la danse du solvant entraîne l'échange de partenaires contre l'atome de magnésium, donnant lieu à l'équilibre de Schlenk, et résultant en les différents composés présents dans la solution.
La danse du réactif de Grignard
Sachant que le réactif de Grignard n'est pas un seul composé bien défini, plutôt un danseur en constante évolution, il est devenu possible de regarder la réaction. Cette tâche a posé plusieurs autres défis à différents niveaux de complexité. Quelle paire de danseurs du ballet Schlenk changerait de partenaire le plus rapidement ? Sens, quels composés présents en solution réagissent vraiment, et comment?
"L'un des avantages d'une étude informatique est que vous n'êtes pas limité par la réalité physique, vous pouvez tester systématiquement plusieurs hypothèses, et déterminer laquelle est la meilleure seulement a posteriori, " dit Cascella.
Par des simulations informatiques accompagnées de données de chimie quantique de haut niveau, grâce à une collaboration avec le professeur Jürgen Gauss (Johannes Gutenberg-University Mayence, Allemagne), il a été possible d'établir une série de points clés. D'abord, presque tous les couples de danseurs finiront par former des liaisons carbone-carbone stables, c'est-à-dire que toutes les molécules produites par l'équilibre de Schlenk favorisent la formation de liaisons carbone-carbone, bien qu'à des taux différents. Seconde, différents partenaires de la danse demandent des pas de danse différents; sens, différentes molécules de substrat réagiront suivant différents mécanismes caractérisés par une séparation hétérolytique ou homolytique de la liaison magnésium-carbone (les deux électrons de la liaison vont au carbone, ou sont partagés à parts égales entre le magnésium et le carbone).
"Ce qui a toujours été connu comme la réaction de Grignard est, en réalité, un groupe de réactions qui se produisent simultanément dans le même échantillon, " dit Cascella.
Leurs études ont démontré que contrairement à d'autres réactions courantes, dans ce cas, le solvant entraîne l'ensemble du processus chimique. C'est aussi l'une des raisons pour lesquelles la réaction de Grignard est restée mystérieuse pendant tant d'années :« Les systèmes dominés par le solvant sont difficiles à étudier, pointe Eisenstein. Leur structure est en constante évolution, et la plupart des méthodes expérimentales ne sont pas (encore) assez bonnes pour voir ce qui se passe réellement. C'est comme essayer de photographier une volée d'oiseaux avec une vitesse d'obturation trop lente. Tout ce que vous pouvez voir sur la photo est un désordre flou de plumes et de formes ressemblant à des oiseaux, mais vous ne pouvez pas décider combien d'oiseaux vous avez, comment ils volent, ou même de quelle espèce il s'agit. On ne peut rien en déduire. C'est là que les méthodes de calcul ont un avantage."
Un cas froid devient chaud
Avoir identifié le mécanisme de cette réaction n'est pas la fin de l'histoire; plutôt, ce n'est qu'un début.
"Nous venons de gratter la surface, " dit Eisenstein. On sait depuis longtemps que les réactions organométalliques peuvent être améliorées avec une grande variété d'additifs, comme les sels, dérivés d'autres composés métalliques, etc. Les additifs peuvent accélérer la réaction, et plus propre. Cependant, personne ne sait vraiment comment ils fonctionnent. Maintenant que nous avons une compréhension suffisante de la réaction de Grignard, nous pouvons construire à partir de cela. Une fois que nous savons comment faire un gâteau, nous pouvons le rendre plus savoureux et plus beau. En d'autres termes, on peut comprendre le rôle des additifs, et j'espère en proposer de nouveaux."
"Pour le futur, cela signifie qu'il pourrait y avoir des moyens de prédire des améliorations pour la réaction, avec toutes les implications que cela aura dans les endroits où la synthèse de molécules est nécessaire, comme en chimie médicale et dans l'industrie. Cette réaction est prototypique pour beaucoup d'autres réactions avec des métaux, " dit Cascella. " Et, de façon inattendue, nous avons découvert que l'espèce la plus réactive a une forme et une structure très similaires au site actif d'un groupe d'enzymes cruciales pour notre existence :les endonucléases. »
Les endonucléases sont des enzymes qui traitent l'ADN dans nos cellules, et ils catalysent la rupture/formation de liaisons en utilisant le magnésium comme cofacteur clé, comme dans la danse de Grignard. Cela ouvre des possibilités intéressantes pour comprendre l'évolution de ces enzymes. Il est probable qu'ils aient commencé par utiliser des outils moins complexes, voies de réaction moins efficaces, puis progressivement évolué en sélectionnant le plus efficace. D'autre part, concevoir des ligands autour des atomes de magnésium qui imitent la structure des enzymes pourrait être une excellente voie pour l'amélioration de la réaction de Grignard elle-même.
Aussi vieux que cela puisse être, la réaction de Grignard s'affirme aujourd'hui comme une grande source d'inspiration pour les chimistes.
Les deux publications sur l'équilibre de Schlenk et la réaction de Grignard sont en accès libre.