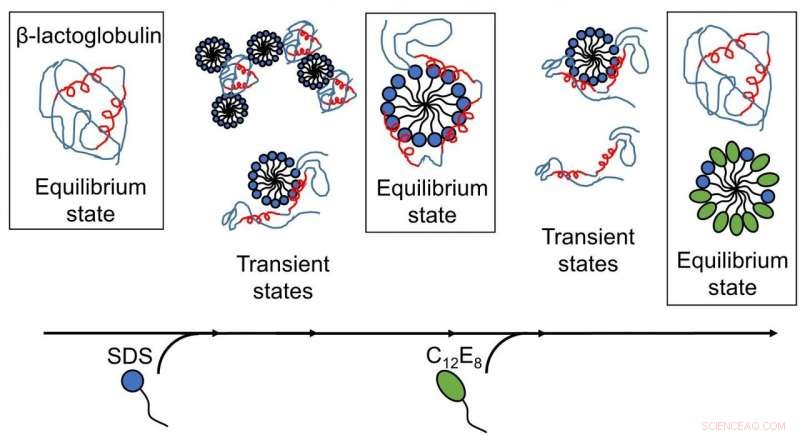
Les résultats publiés par les chercheurs de l'UA révèlent que le dépliement et le repliement des protéines induits par les surfactants sont des processus complexes avec plusieurs structures présentes, et les réarrangements se produisent sur des échelles de temps allant de quelques millisecondes à quelques minutes. (Image :Reproduit avec la permission de la Royal Society of Chemistry). Crédit: Chimie Sci , copyright 2020 Société royale de chimie.
Comprendre les interactions entre les protéines et les molécules de savon (tensioactifs) a longtemps été important pour l'industrie, notamment dans les détergents et les cosmétiques. Le tensioactif anionique dodécyl sulfate de sodium (SDS) est connu pour déplier les protéines globulaires, tandis que le tensioactif non ionique octaéthylène glycol monododécyl éther (C12E8) fait le contraire, c'est-à-dire qu'il aide les protéines à reprendre leur forme.
Pour que les lessives en poudre agissent efficacement, il est important que les tensioactifs ne modifient pas la structure des protéines (enzymes), car tout changement dans la structure enzymatique tue leur capacité à décomposer les taches et à éliminer la saleté. La plupart des lessives en poudre contiennent des mélanges de tensioactifs qui permettent aux enzymes de rester actives. Aussi, certaines biotechnologies exploitent des tensioactifs en combinaison avec des protéines.
Les protéines membranaires siègent généralement dans la membrane cellulaire. Afin de les extraire de cet environnement pour différentes études, ils doivent être solubilisés par un tensioactif. Le tensioactif doit être « doux » et ne couvrir que la partie de la protéine insérée dans la membrane afin que leur structure soit préservée. En revanche, lors de la caractérisation du poids moléculaire des protéines en laboratoire, une technique classique consiste à les déplier par le tensioactif agressif chargé négativement, FDS, et surveiller comment ils migrent dans un gel polymère dans un champ électrique. Cette technique ne fonctionne que si le tensioactif déplie complètement les protéines et détruit leur structure.
Il y a encore un débat sur le type d'interactions entre la protéine et le tensioactif qui est le plus important. S'agit-il des interactions électrostatiques entre les charges du tensioactif et de la protéine, ou s'agit-il simplement des propriétés de l'interface des agrégats (micelles) que les tensioactifs forment dans l'eau, qui sont responsables du déploiement de la protéine ?
Alors que le déroulement a été étudié en détail au niveau des protéines, une image complète de l'interaction entre la protéine et le surfactant fait défaut dans ces processus. Ce manque de connaissances est abordé dans les travaux actuels utilisant la protéine globulaire -lactoglobuline (bLG) comme protéine modèle.
La bonne combinaison de techniques expérimentales
Une meilleure compréhension du dépliement et du repliement des protéines a été obtenue, car les différentes étapes des interactions entre tensioactif et protéines ont été cartographiées en fonction du temps. Premièrement, la protéine modèle, bLG, a été mélangé avec le tensioactif anionique SDS en suivant l'évolution temporelle de la formation de complexes entre protéines et molécules de tensioactif à l'échelle de la milliseconde minute. Les chercheurs ont ainsi déterminé la structure des complexes en évolution. Par la suite, ils ont cartographié l'évolution dans le temps du processus de repliement lorsque du surfactant non chargé (C12E8) a été ajouté à un échantillon contenant des complexes de SDS et de protéine.
Afin d'observer comment la protéine se réarrange au cours du processus de dépliage et de repliement induit par les tensioactifs, techniques spectroscopiques complémentaires, dichroïsme circulaire et fluorescence tryptophane, ont été utilisés en combinaison avec la diffusion des rayons X aux petits angles (SAXS) résolue en temps.
Le dichroïsme circulaire et la fluorescence du tryptophane surveillent les changements dans la structure de bLG, tandis que les changements dans la forme globale des complexes protéine-tensioactif ont été suivis par le synchrotron SAXS. Cette combinaison de techniques n'a pas été utilisée auparavant pour étudier ces processus.
Processus complexes d'une durée de quelques millisecondes à quelques minutes
Le déploiement de la protéine par SDS était un processus homogène, où toutes les molécules de protéines suivent le même chemin de dépliement. Les complexes SDS (micelles) attaquent de front les molécules protéiques puis déplient progressivement la protéine pour qu'elle forme une enveloppe autour de la micelle SDS. Le repliement démarre lorsque les micelles C12E8 « aspirent » le SDS du complexe protéine-SDS pour former des micelles mixtes SDS-C12E8. Cependant, le processus de repliement proprement dit semble suivre plusieurs voies, puisque plusieurs structures se sont formées en parallèle, à savoir des complexes protéine-tensioactif (contenant probablement à la fois du SDS et du C12E8), mixed micelles of SDS and C12E8, "naked" proteins unfolded like long polymeric chains, and properly folded proteins. The experiment allowed the interconversion between these species to be followed, so that it could be determined which of the processes are fast and which ones are slow. The folded protein could form both from the naked unfolded proteins (quickly) and from protein-surfactant complexes (more slowly). Ainsi, the best way in which surfactants can help a protein to fold is to basically get out of the way and let the protein find its own way back to the folded state.
The results have provided deeper insight into the structural changes occurring at the protein-surfactant level. They revealed that surfactant-mediated unfolding and refolding of proteins are complex processes of rearrangements occurring on time scales from below milliseconds to minutes and involve intimate collaboration between surfactant complexes and proteins.