Crédit :Université McGill
Des chercheurs de la Faculté de médecine de l'Université McGill ont fait d'importants progrès dans la compréhension du fonctionnement des enzymes qui jouent un rôle essentiel dans la production d'antibiotiques et d'autres produits thérapeutiques. Leurs conclusions sont publiées dans Science .
"Beaucoup de médicaments sur lesquels nous comptons aujourd'hui sont des produits naturels, fabriqué par la flore terrestre, " explique le Dr Martin Schmeing, Professeur agrégé au Département de biochimie de McGill et auteur principal de l'étude. "Cela inclut les composés fabriqués dans les microbes par des enzymes massives appelées peptides synthétases non ribosomiques, ou NRPS. Les NRPS synthétisent toutes sortes d'antibiotiques, qui peut tuer les champignons et les bactéries dangereux, ainsi que des composés pour nous aider à combattre les infections virales et les cancers. Par exemple, ces composés comprennent la viomycine, un antibiotique utilisé pour le traitement de la tuberculose multirésistante; ciclosporine, qui a été largement utilisé comme immunosuppresseur dans les greffes d'organes; et l'antibiotique bien connu pénicilline."
Afin de synthétiser ces médicaments, Les NRPS fonctionnent comme une chaîne de montage en usine, composé d'une série de postes de travail. Chaque gare, appelé "module, " a des flux de travail en plusieurs étapes et des pièces mobiles qui lui permettent d'ajouter un composant de base au médicament en croissance.
Comprendre le fonctionnement interne de la chaîne de montage
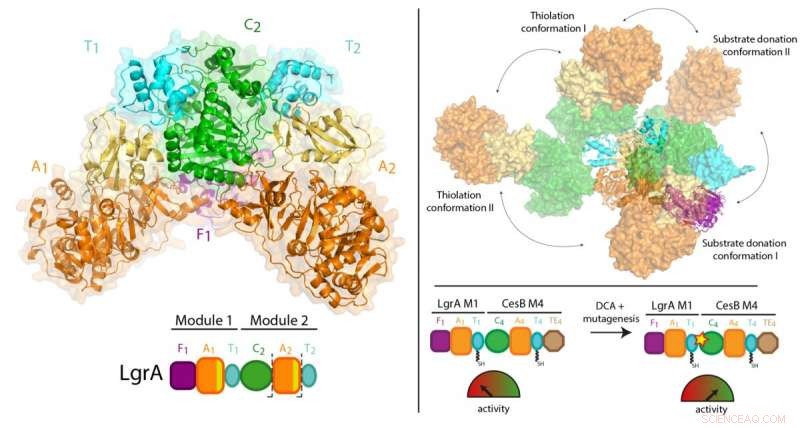
Les travaux antérieurs du Dr Schmeing et d'autres ont permis de bien comprendre le fonctionnement d'un module. Maintenant, en utilisant une technique appelée cristallographie aux rayons X à la Canadian Light Source en Saskatchewan, et la source avancée de photons dans l'Illinois, l'équipe a pu prendre des photos 3D ultra-haute résolution des NRPS.
Pour la première fois, ils ont pu faire des observations de haute qualité sur la façon dont un module individuel se rapporte à la plus grande chaîne de montage, en visualisant une partie à deux modules des NRPS qui fabriquent l'antibiotique gramicidine linéaire (que l'on trouve dans les traitements Polysporin). L'étude a révélé un surprenant manque de synchronisation entre les modules à tous les points autres que lorsqu'ils doivent se coordonner pour passer l'intermédiaire d'un poste de travail à l'autre. En outre, ils ont constaté que les modules ne s'alignent pas en ligne droite ou d'une autre manière organisée, mais peut à la place s'aligner dans de nombreuses positions relatives différentes. "Ce niveau de flexibilité massive n'était pas attendu, " note le Dr Schmeing, qui est également directeur du Centre de biologie structurale de McGill. "Les enzymes font de la gymnastique."
Parce que les protéines sont piégées dans un cristal, on a pris soin de confirmer que les résultats étaient représentatifs de ce qui se passe dans la vie réelle. Le Dr Schmeing a travaillé avec son collègue, Dr Alba Guarné, Professeur au Département de biochimie de McGill, d'utiliser des données de solution complémentaires, collectés à l'Advanced Light Source à Berkeley pour valider les observations. « La communauté de biologie structurale est très forte à McGill. Nous travaillons ensemble pour nous entraider dans des collaborations, obtenir les équipements biophysiques nécessaires aux expérimentations de pointe, et de former nos étudiants », déclare le Dr Schmeing, notant que les expérimentateurs sur le papier, Janice Reimer, Max Eivaskhani et Ingrid Harb, sont tous des étudiants diplômés talentueux de McGill. « L'environnement et les collègues du Centre McGill de biologie structurale sont importants pour le succès continu de nos laboratoires.
Implications futures pour la conception thérapeutique
Les résultats pourraient avoir des implications pour la production de nouveaux antibiotiques et thérapeutiques à long terme. Depuis leur découverte, les scientifiques ont été enthousiasmés par la possibilité de bio-ingénierie des NRPS en mélangeant et en faisant correspondre les postes de travail pour produire des composés de conception. "Notre étude montre qu'il devrait être possible de mélanger et assortir ces modules, mais que les NRPS bio-ingénierie doivent être modifiés aux points impliqués dans le passage du composé d'un module à l'autre pour qu'ils fonctionnent bien, " explique le Dr Schmeing. " C'est quelque chose que nous avons fait avec Martin Weigt de la Sorbonne pour faire une preuve de principe dans le papier, mais qui devra être optimisé pour la production de thérapies de conception. »
"Les structures d'une peptide synthétase non ribosomique dimodulaire révèlent une flexibilité conformationnelle, " par Reimer, J.M., Eivaskhani, M, Harb, JE., Guarné, UNE, Poids, M., Schmeing, T. M. a été publié dans la revue Science .